题目内容
15.某化学研究性学习小组用CO还原Fe2O3,并在实验结束后用磁铁吸出生成的黑色粉末X进行探究.[探究目的]分析黑色粉末X的组成,并进行相关实验.
[查阅资料]
①CO还原Fe2O3的实验中若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引.
②Fe3O4+8H+=2Fe3++Fe2++4H2O
③Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O
④3Fe3O4+28HNO3(稀)=9Fe(NO3)3+NO↑+14H2O
[实验探究]
I.定性检验
| 编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管1中,注入浓盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色;有气泡产生 |
| ② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液出现血红色 |
| ③ | 另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置 | 有极少量红色物质析出,仍有较多黑色固体未溶解 |
(2)上述实验说明黑色粉末X中含有Fe3O4和Fe的混合物.
II.定量测定
根据如图所示的实验方案进行实验并记录数据:
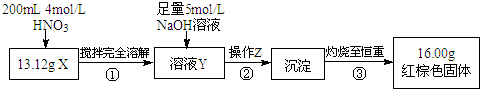
(1)操作Z的名称是过滤.
(2)通过以上数据,得出13.12g黑色粉末X中各成分的物质的量为Fe:0.11mol、Fe3O4:0.03mol.
(3)若溶液Y的体积仍为200mL,则溶液Y中c(Fe3+)=1mol/L.
分析 I.(1)极少量红色物质为铜,该反应为铁粉和硫酸铜反应生成铜和硫酸亚铁,发生了金属的置换反应.
(2)通过①③可判断Fe的存在.再通过Ⅰ可知黑色粉末为铁与Fe3O4.
Ⅱ.(1)通过加硝酸溶解和足量的氢氧化钠溶液,生成了氢氧化铁沉淀,因此操作Z为过滤;
(2)红棕色固体为氧化铁,根据铁原子物质的量守恒和Fe3O4和Fe的质量为13.12g列式计算;
(3)溶液Y中铁离子的物质的量为0.2mol,带入c=$\frac{n}{V}$计算.
解答 解:I.(1)极少量红色物质为铜,该反应为铁粉和硫酸铜反应生成铜和硫酸亚铁,发生了金属的置换反应,离子方程式为Fe+Cu2+=Fe2++Cu,
故答案为:Fe+Cu2+=Fe2++Cu;
(2)铁能和盐酸反应生成气体,且铁和铜离子发生置换反应生成红色的铜,据此现象判断存在铁;Fe3+能使KSCN溶液呈现血红色,这是Fe3+的特征反应,据此判断Fe3O4的存在.故黑色粉末X为Fe3O4和Fe的混合物.
故答案为:Fe3O4和Fe的混合物;
Ⅱ.(1)通过加硝酸溶解和足量的氢氧化钠溶液,生成了氢氧化铁沉淀,因此操作Z为过滤,
故答案为:过滤;
(2)红棕色固体为氧化铁,16g氧化铁中含有铁原子的物质的量为$\frac{16g}{160g/mol}$×2=0.2mol,设13.12g混合固体中铁的物质的量为xmol,Fe3O4的物质的量为ymol,则
①x+3y=0.2mol②56x+232y=13.12 两式联立求得x=0.11mol,y=0.03mol,
故答案为:Fe:0.11mol、Fe3O4:0.03mol;
(3)通过(2)中计算可知铁离子的物质的量为0.2mol,因此c(Fe3+)=$\frac{0.2mol}{0.2L}$=1mol/L,
故答案为:1.
点评 本题考查了铁及其重要化合物的性质,涉及化学实验基本操作、物质的量的计算等基本原理以及定量计算测定等,对知识综合运用,考查思维能力,难度较大,清楚实验原理、思路.

| A. | 铁和稀盐酸溶液反应 2Fe+6H+═2Fe2++6H2↑ | |
| B. | 醋酸和小苏打溶液反应 CH3COOH+HCO3-═CH3COO-+H2O+CO2↑ | |
| C. | 二氧化碳和少量烧碱溶液反应 CO2+2OH-═CO32-+H2O | |
| D. | 氯化亚铁和氯气反应生成氯化铁 Fe2++Cl2═Fe3++2Cl- |
| A. | 32 | B. | 32 g•mol-1 | C. | 64 g•mol-1 | D. | 64 |
| A. | ${\;}_{92}^{235}$U 原子核中含有92个中子 | |
| B. | ${\;}_{92}^{235}$U 原子核外有143个电子 | |
| C. | ${\;}_{92}^{235}$U 的质量数为92 | |
| D. | ${\;}_{92}^{235}$U 与${\;}_{92}^{238}$U 互为同位素 |
| A. | 焰色反应为化学变化 | |
| B. | 用完的铂丝用稀硫酸清洗 | |
| C. | 可用焰色反应区别NaCl和KCl溶液 | |
| D. | 焰色反应为黄色,样品一定不含钾元素 |
 在一定条件下,合成塔中氮气和氢气的起始浓度分别为a mol•L-1和b mol•L-1,反应为:N2+3H2?2NH3,氨气的浓度随时间变化如图所示.
在一定条件下,合成塔中氮气和氢气的起始浓度分别为a mol•L-1和b mol•L-1,反应为:N2+3H2?2NH3,氨气的浓度随时间变化如图所示.