题目内容
18.相同质量的H2SO4和H3PO4具有不同的( )| A. | 分子数 | B. | 原子数 | C. | 电子数 | D. | 氧原子数 |
分析 H2SO4和H3PO4的摩尔质量均为98g/mol,相同质量的H2SO4和H3PO4的物质的量相等,含有分子数目相等,H2SO4和H3PO4分子中含有电子数、氧原子数目相等,含有原子数目不相等.
解答 解:H2SO4和H3PO4的摩尔质量均为98g/mol,相同质量的H2SO4和H3PO4的物质的量相等,含有分子数目相等,H2SO4和H3PO4分子中均含有50个电、4个氧原子,故含有电子总数、氧原子总数相等,含有原子数目之比为8:9,则含有原子数目不相等,
故选:B.
点评 本题考查物质的量有关计算,比较基础,注意对化学式的理解掌握.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.溴化碘(IBr)的化学性质类似卤素单质,它与水反应的化学方程式是IBr+H2O=HBr+HIO.下列有关IBr的叙述不正确的是( )
| A. | IBr跟水的反应是非氧化还原反应 | |
| B. | 在很多反应中,IBr是强氧化剂 | |
| C. | IBr是共价化合物 | |
| D. | IBr跟NaOH稀溶液反应生成NaI、NaBrO和H2O |
3.下列离子方程式书写正确的是( )
| A. | 铁和稀盐酸溶液反应 2Fe+6H+═2Fe2++6H2↑ | |
| B. | 醋酸和小苏打溶液反应 CH3COOH+HCO3-═CH3COO-+H2O+CO2↑ | |
| C. | 二氧化碳和少量烧碱溶液反应 CO2+2OH-═CO32-+H2O | |
| D. | 氯化亚铁和氯气反应生成氯化铁 Fe2++Cl2═Fe3++2Cl- |
10.标准状况下,32g某气体的分子数目为0.5NA个,则该气体的摩尔质量为( )
| A. | 32 | B. | 32 g•mol-1 | C. | 64 g•mol-1 | D. | 64 |
7.五彩缤纷的焰火与元素的焰色反应有关.下列关于金属元素焰色反应说法正确的是( )
| A. | 焰色反应为化学变化 | |
| B. | 用完的铂丝用稀硫酸清洗 | |
| C. | 可用焰色反应区别NaCl和KCl溶液 | |
| D. | 焰色反应为黄色,样品一定不含钾元素 |
8.下列装置不能完成相应实验的是( )
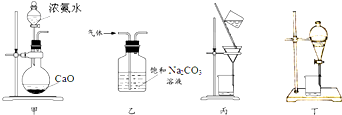

| A. | 甲装置可用于制备氨气 | |
| B. | 乙装置可除去CO2中少量的SO2杂质 | |
| C. | 丙装置可用于粗盐提纯 | |
| D. | 丁装置可分离CCl4萃取碘水后的分层液体*g3 e) i!d5 O5 E#L1 G |