题目内容
15.工业上用铝土矿 (主要成分为Al2O3、Fe2O${\;}_{{\;}_{3}}$、SiO2)提取氧化铝做冶炼铝的原料,提取的操作过程如下:
(1)第一步在铝土矿中加入盐酸后的实验基本操作是过滤,若在固体B中加入氢氧化钠溶液会(填”会”或”不会”)发生反应,若会,则写出反应的离子方程式SiO2+2OH-=SiO32-+H2O
(2)验证滤液A中是否含Fe3+,可取少量滤液A并加入硫氰化钾(填试剂化学式),现象是取少量滤液A,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+,溶液不变红色,说明滤液中不含Fe3+.
(3)在整个操作过程中否(填“是”“否”)有氧化还原反应;写出碳酸氢钠的一种用途制纯碱或做发酵粉等.
分析 由流程可知,加盐酸,只有SiO2不反应,氧化铝、氧化铁均与盐酸反应,过滤沉淀为SiO2;滤液中加过量NaOH,铝离子转化为偏铝酸钠,铁离子转化沉淀,过滤后,滤液D与二氧化碳反应生成氢氧化铝和碳酸氢钠,最后氢氧化铝分解生成氧化铝,以此来解答.
解答 解:(1)①加盐酸,只有SiO2不反应,氧化铝、氧化铁均与盐酸反应,所以加入盐酸后的实验基本操作是过滤,二氧化硅是酸性氧化物,能与碱反应生成硅酸钠,SiO2+2OH-=SiO32-+H2O,故答案为:过滤;会;SiO2+2OH-=SiO32-+H2O;
(2)Fe3+与硫氰化钾溶液反应,使溶液变红色,检验滤液A中是否含Fe3+离子的方法为:取少量滤液A,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+,溶液不变红色,说明滤液中不含Fe3+,
故答案为:硫氰化钾;取少量滤液A,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+,溶液不变红色,说明滤液中不含Fe3+;
(3)整个过程所有反应无化合价的变化,无氧化还原反应;碳酸氢钠可用于制纯碱或做发酵粉等,
故答案为:否;制纯碱或做发酵粉等.
点评 本题以氧化铝提取工艺流程为载体考查混合物分离实验方案的设计,为高频考点,涉及无机物推断、元素化合物性质及相互转化、除杂的方法、离子方程式等,侧重分析与实验能力的考查,题目难度中等.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
6. 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
(1)该实验应选用酚酞作指示剂,向锥形瓶中移取一定体积的白醋所用的仪器是酸式滴定管.
(2)滴定至终点的判断方法当滴入最后一滴NaOH溶液,溶液颜色由无色变为浅红色(或红色),半分钟内不褪色
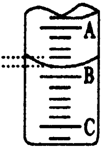
(3)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的 刻度
为25,滴定管中液面读数应为25.40mL,此时滴定管中液体的体积大于24.60mL.
(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是BCD.
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗,
E.该NaOH标准液保存时间过长,有部分变质,浓度降低
F.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(5)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):C=$\frac{\frac{25.35mL+25.30mL}{2}×cmol•{L}^{-1}}{VmL}$.
 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
(2)滴定至终点的判断方法当滴入最后一滴NaOH溶液,溶液颜色由无色变为浅红色(或红色),半分钟内不褪色
(3)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的 刻度
为25,滴定管中液面读数应为25.40mL,此时滴定管中液体的体积大于24.60mL.
(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗,
E.该NaOH标准液保存时间过长,有部分变质,浓度降低
F.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(5)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):C=$\frac{\frac{25.35mL+25.30mL}{2}×cmol•{L}^{-1}}{VmL}$.
7.已知铁离子,氯气、溴均为常见的氧化剂,某化学兴趣小组设计了如下实验探究其强弱:
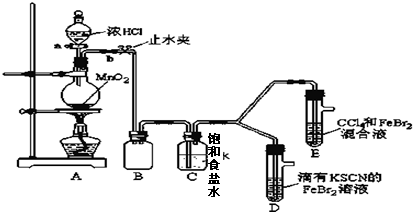
(1)①装置A中发生反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;△\;}}{\;}$Mn2++Cl2↑+2H2O.②整套实验装置存在一处明显的不足,请指出缺少尾气处理装置.
(2)用改正后的装置进行实验,实验过程如下:
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化.
D装置中:红色慢慢褪去.
E装置中:CCl4层颜色逐渐加深,直至变成红色.
为探究上述实验现象的本质,小组同学查得资料如下:
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因过量氯气和SCN-反应2SCN-+Cl2=2Cl-+(SCN)2,使SCN-浓度减小,则使Fe3++3SCN-?Fe(SCN)3平衡向逆反应方向移动而褪色.
现设计简单实验证明上述解释:取少量褪色后的溶液,滴加KSCN溶液溶液,若溶液颜色变红色.则上述解释是合理的.
小组同学另查得资料如下:
②欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生.请结合上述资料用两步离子方程式解释仅产生白色沉淀原因BrCl+H2O=HBrO+H++Cl-、Ag++Cl-=AgCl↓.

(1)①装置A中发生反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;△\;}}{\;}$Mn2++Cl2↑+2H2O.②整套实验装置存在一处明显的不足,请指出缺少尾气处理装置.
(2)用改正后的装置进行实验,实验过程如下:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后 关闭活塞a,点燃酒精灯. (填具体实验操作) | D装置中:溶液变红 E装置中:水层溶液变黄,振荡后,下层CCl4层无明显变化.一段时间后CCl4层由无色变为橙色.(填实验现象) | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: Cl2>Br2>Fe3+ |
D装置中:红色慢慢褪去.
E装置中:CCl4层颜色逐渐加深,直至变成红色.
为探究上述实验现象的本质,小组同学查得资料如下:
| ⅰ.Fe3++3SCN-?Fe(SCN)3 是一个可逆反应. ⅱ.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2. |
现设计简单实验证明上述解释:取少量褪色后的溶液,滴加KSCN溶液溶液,若溶液颜色变红色.则上述解释是合理的.
小组同学另查得资料如下:
| ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应. ⅳ.AgClO、AgBrO均可溶于水. |
5.锗和铝在周期表中位于对角线位置,两者性质很相似.下列关于锗和锗的化合物性质推断正确的是( )
| A. | 锗不能与强碱溶液反应 | B. | 氢氧化锗有两性 | ||
| C. | 氧化锗易溶于水 | D. | 氧化锗的化学式为Ge2O3 |
 乙炔是有机合成工业的一种原料.工业上曾用CaC2与水反应生成乙炔.
乙炔是有机合成工业的一种原料.工业上曾用CaC2与水反应生成乙炔. ;1mol O22+中含有的π键数目为2NA.
;1mol O22+中含有的π键数目为2NA.


 (1)重要的饱和一元脂肪醛有甲醛,其质量分数在35%~40%的水溶液俗称福尔马林.化学性质与乙醛相似,能被氢气还原成甲醇,能被O2、高锰酸钾酸性溶液、溴水、银氨溶液、新制的Cu(OH)2氧化,写出乙醛与银氨溶液反应的方程式CH3CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH3COONH4+2Ag+3NH3+H2O.
(1)重要的饱和一元脂肪醛有甲醛,其质量分数在35%~40%的水溶液俗称福尔马林.化学性质与乙醛相似,能被氢气还原成甲醇,能被O2、高锰酸钾酸性溶液、溴水、银氨溶液、新制的Cu(OH)2氧化,写出乙醛与银氨溶液反应的方程式CH3CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH3COONH4+2Ag+3NH3+H2O.