题目内容
7.下列化学反应属于吸热反应的是( )| A. | Ba(OH)2•8H2O+2NH4Cl=BaCl2•6H2O+2NH3•2H2O+2H2O | |
| B. | Ba(OH)2+H2SO4=BaSO4↓+2H2O | |
| C. | 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ | |
| D. | 8Al+3Fe3O4=4Al2O3+9Fe |
分析 常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应、所有中和反应、绝大多数化合反应和铝热反应;常见的吸热反应有:绝大数分解反应、个别的化合反应(如C和CO2)、少数分解、置换以及某些复分解反应,以此解答该题.
解答 解:A.氢氧化钡晶体与NH4Cl晶体混合制氨是铵盐和强碱的反应,属于吸热反应,故A正确;
B.酸碱中和为放热反应,故B错误;
C.活泼金属与强酸、强碱的反应为放热反应,故C错误;
D.铝热反应为放热反应,故D错误.
故选A.
点评 本题考查化学反应与能量变化,为高频考点,侧重于双基的考查,抓住中学化学中常见的吸热或放热的反应是解题的关键,对于特殊过程中的热量变化的要熟练记忆来解答此类习题,难度不大.

练习册系列答案
相关题目
15.下列关于铷的叙述中正确的是( )
| A. | 硝酸铷是离子化合物 | |
| B. | 在钠、钾、铷三种单质中,铷的熔点最高 | |
| C. | 氢氧化铷是弱碱 | |
| D. | 它位于周期表的第四周期、第ⅠA族 |
6.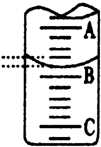 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
(1)该实验应选用酚酞作指示剂,向锥形瓶中移取一定体积的白醋所用的仪器是酸式滴定管.
(2)滴定至终点的判断方法当滴入最后一滴NaOH溶液,溶液颜色由无色变为浅红色(或红色),半分钟内不褪色
(3)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的 刻度
为25,滴定管中液面读数应为25.40mL,此时滴定管中液体的体积大于24.60mL.
(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是BCD.
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗,
E.该NaOH标准液保存时间过长,有部分变质,浓度降低
F.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(5)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):C=$\frac{\frac{25.35mL+25.30mL}{2}×cmol•{L}^{-1}}{VmL}$.
 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
(2)滴定至终点的判断方法当滴入最后一滴NaOH溶液,溶液颜色由无色变为浅红色(或红色),半分钟内不褪色
(3)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的 刻度
为25,滴定管中液面读数应为25.40mL,此时滴定管中液体的体积大于24.60mL.
(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗,
E.该NaOH标准液保存时间过长,有部分变质,浓度降低
F.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(5)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):C=$\frac{\frac{25.35mL+25.30mL}{2}×cmol•{L}^{-1}}{VmL}$.
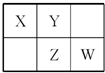 四种短周期元素在周期表中的相对位置如图所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.
四种短周期元素在周期表中的相对位置如图所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.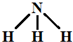 (写结构式);
(写结构式); ;
;

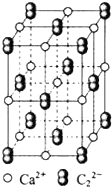 乙炔是有机合成工业的一种原料.工业上曾用CaC2与水反应生成乙炔.
乙炔是有机合成工业的一种原料.工业上曾用CaC2与水反应生成乙炔.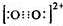 ;1mol O22+中含有的π键数目为2NA.
;1mol O22+中含有的π键数目为2NA.