题目内容
2.能促使水的电离平衡右移,并使溶液中的c(H+)>c(OH-)的操作是( )| A. | 向水中通入二氧化硫气体 | B. | 向水中加入少量氯化铁固体 | ||
| C. | 将水加热煮沸 | D. | 向水中加入碳酸钠晶体 |
分析 c(H+)>c(OH-),溶液呈酸性,再根据影响水的电离的因素:温度、同离子效应、所加物质的酸碱性等具体分析水的电离平衡的移动.
解答 解:A、二氧化硫溶于水形成碳酸,溶液中的c(H+)>c(OH-),酸对水的电离起抑制作用,平衡向左移动,故A错误;
B、加入少量氯化铁固体,铁离子水解,促进水的电离,且导致溶液中的c(H+)>c(OH-),故B正确;
C、加热时促进水的电离,但是氢离子和氢氧根浓度依然相等,溶液仍然呈中性,故C错误;
D、加入碳酸钠晶体,碳酸根水解导致溶液中的c(H+)<c(OH-),故D错误,故选B.
点评 本题考查学生水的电离的影响因素,酸碱均抑制水的电离,较简单.

练习册系列答案
 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
12.下列各组物质的关系描述正确的是( )
| A. | H2O与D2O属同系物 | |
| B. | 35Cl与37Cl属同素异形体 | |
| C. | O2与O3属同位素 | |
| D. | 乙醇与二甲醚(CH3-O-CH3)属同分异构体 |
17.常温下,100mL pH=12的氢氧化钠溶液与100mL pH=2的醋酸溶液相混合后,所得的混合液( )
| A. | 显酸性 | B. | 显碱性 | ||
| C. | 显中性 | D. | 不能确定其酸碱性 |
7.如图为元素周期表短周期的一部分.有关A、B、C、D四种元素的叙述中,错误的是( )
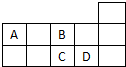

| A. | A和B可形成AB32-、A2B42-等离子 | |
| B. | B的氢化物的沸点低于C的氢化物的沸点 | |
| C. | 单质C的晶体中含有共价键和范德华力 | |
| D. | 由A、D形成的一种物质可用以提取碘水中碘单质 |
14.下列有关元素的性质及其规律正确的是( )
| A. | IA族与 VIIA族元素间可形成共价化合物或离子化合物 | |
| B. | 同主族元素的非金属性越强,其简单阴离子还原性越强 | |
| C. | 同周期金属元素的化合价越高,其原子失电子能力越强 | |
| D. | 第二周期元素的最高价从左到右,由+1递增到+7 |
11.下列说法正确的是( )
| A. | 电解MgCl2饱和溶液可制得金属镁 | |
| B. | 用浓硫酸与铁反应能增大生成H2的速率 | |
| C. | 电解饱和食盐水的过程中,水的电离平衡正向移动 | |
| D. | 纯银器在空气中露置其表面因电化学腐蚀渐渐变暗 |


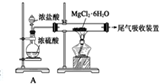 ,其中装置A的作用是制备干燥的HCl气体
,其中装置A的作用是制备干燥的HCl气体