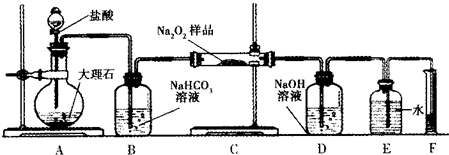
题目内容
17.常温下,100mL pH=12的氢氧化钠溶液与100mL pH=2的醋酸溶液相混合后,所得的混合液( )| A. | 显酸性 | B. | 显碱性 | ||
| C. | 显中性 | D. | 不能确定其酸碱性 |
分析 醋酸为弱酸,强氧化钠为强碱,则pH=2的醋酸,其浓度大于0.01mol/L,pH=12的氢氧化钠,其浓度等于0.01mol/L,等体积混合后,醋酸过量,溶液呈酸性.
解答 解:醋酸为弱电解质,在溶液中部分电离出氢离子,则pH=2的醋酸溶液的浓度大于0.01mol/L,
强氧化钠为强电解质,则pH=12的氢氧化钠的浓度等于0.01mol/L,
两溶液等体积混合后,醋酸过量,则溶液显酸性,
故选A.
点评 本题考查弱电解质的电离平衡,为高频考点,题目难度中等,注意把握弱电解质的电离特点及其影响因素,明确酸碱混合的定性判断方法.

练习册系列答案
相关题目
7.下列有关元素周期表说法正确的是( )
| A. | 过渡元素全部是金属元素 | |
| B. | 元素周期表有18个纵行,即有18个族 | |
| C. | 短周期是指第一、二、三、四周期 | |
| D. | VA族的元素全部是非金属元素 |
8.下列过程与盐类水解无关的是( )
| A. | 利用明矾净化浊水 | |
| B. | 实验室制氢气时加CuSO4可加快反应速率 | |
| C. | 配制FeCl3溶液时,加少量稀盐酸 | |
| D. | 实验室通常使用热的纯碱溶液去除油污 |
5.下列离子方程式中,正确的是( )
| A. | 将氨气通入醋酸中:NH3+H+═NH4+ | |
| B. | 在NH4Cl溶液中滴入氢氧化钠溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 将少量铜屑放入稀硝酸中:Cu+4H++NO3-═Cu2++NO↑+2H2O | |
| D. | 将稀硝酸滴在铁片上:Fe+2H+═Fe2++H2↑ |
2.能促使水的电离平衡右移,并使溶液中的c(H+)>c(OH-)的操作是( )
| A. | 向水中通入二氧化硫气体 | B. | 向水中加入少量氯化铁固体 | ||
| C. | 将水加热煮沸 | D. | 向水中加入碳酸钠晶体 |
6.常温下,向10ml pH=10 的NaOH 溶液中逐滴加入 pH=4的一元酸HA溶液至pH刚好等于7(假设反应前后溶液体积不变即溶液体积能简单相加),则对反应后溶液的叙述正确的是( )
| A. | c(A-)>c(Na+) | B. | c(H+)=c(OH-)<c(Na+)<c(A-) | ||
| C. | V(混)≥20mL | D. | V(混)≤20mL |
7.化学与生活密切相关.据了解同学们的家中常备如下生活用品:碘酒、食盐、食醋、84消毒液(内含NaClO),利用上述用品你不能完成的任务是( )
| A. | 除去保温瓶中的水垢 | B. | 检验自来水中是否含有Cl- | ||
| C. | 检验买来的奶粉中是否加有淀粉 | D. | 洗去白色衣服上的番茄汁 |
 乙烯的产量可以用来衡量一个国家的石油化工发展水平,这是因为乙烯能够转化为许多重要的有机化工原料,例如:
乙烯的产量可以用来衡量一个国家的石油化工发展水平,这是因为乙烯能够转化为许多重要的有机化工原料,例如: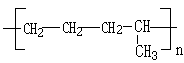 、
、 .
. CH3COOC2H5+H2O.
CH3COOC2H5+H2O.