题目内容
【题目】钠离子电池具有成本低、能量转换效率高、寿命长等优点。一种钠离子电池用碳基材料 (NamCn)作负极,利用钠离子在正负极之间嵌脱过程实现充放电,该钠离子电池的工作原理 为Na1-mCoO2+NamCn![]() NaCoO2+Cn。下列说法不正确的是
NaCoO2+Cn。下列说法不正确的是
A.放电时,Na+向正极移动
B.放电时,负极的电极反应式为NamCn—me-=mNa++Cn
C.充电时,阴极质量减小
D.充电时,阳极的电极反应式为NaCoO2-me-=Na1-mCoO2+mNa+
【答案】C
【解析】
A.放电时,阳离子向正极移动,阴离子向负极移动,故A不选;
B.放电时,负极是金属钠失去电子,故电极反应式为NamCn—me-=mNa++Cn,故B不选;
C.充电时,阴极的电极反应式为mNa++Cn+me-= NamCn,电极质量增加,故C选;
D.充电时,阳极是NaCoO2中的Co失去电子转化为Na1-mCoO2,电极反应式为NaCoO2-me-=Na1-mCoO2+mNa+,故D不选。
故选C。

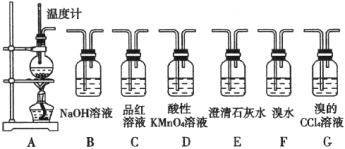
【题目】煤燃烧排放的烟气含有SO2和NOx,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝完成下列填空:
(1)上述烟气处理过程中涉及到的化学物质,其组成元素中属于第三周期元素的是______;写出N的核外电子排布式______。
(2)已知SO2分子的空间构型折线形,则SO2为______(选填“极性”、“非极性”)。
(3)将含有SO2和NOx的烟气通入盛有NaClO2溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如下(其他离子忽略不计):
离子 | Na+ | SO42- | NO3- | OH- | Cl- |
浓度/(molL-1) | 5.5×10-3 | 8.5×10-4 | y | 2.0×10-4 | 3.4×10-3 |
①表中y=______molL-1。
②写出NaClO2溶液吸收SO2的离子方程式______。
(4)烟气中的SO2还可采用氨法脱硫除去,其反应原理可用如图表示。
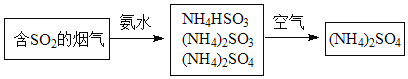
①写出SO2跟氨水反应生成NH4HSO3的化学方程式______。
②(NH4)2HSO3溶液中浓度最大的离子是______。
【题目】工业常用燃料与水蒸气反应制备H2和CO,再用H2和CO合成甲醇。
(1)制取H2和CO通常采用:C(s)+H2O(g)CO(g)+H2(g)△H=+131.4kJmol-1,下列判断正确的是_______。
a.该反应的反应物总能量小于生成物总能量
b.标准状况下,上述反应生成1L H2气体时吸收131.4 kJ的热量
c.若CO(g)+H2(g)C(s)+H2O(1)△H=﹣QkJmol-1,则Q<131.4
d.若C(s)+CO2(g)2CO(g)△H1;CO(g)+H2O(g)H2(g)+CO2(g)△H2则:△H1+△H2=+131.4kJmol-1
(2)甲烷与水蒸气反应也可以生成H2和CO,该反应为:CH4(g)+H2O(g)CO(g)+3H2(g)。已知在某温度下2L的密闭绝热容器中充入2.00mol甲烷和1.00mol水蒸气,测得的数据如表:
不同时间各物质的物质的量/mol | ||||
0min | 2min | 4min | 6min | |
CH4 | 2.00 | 1.76 | 1.60 | n2 |
H2 | 0.00 | 0.72 | n1 | 1.20 |
根据表中数据计算:
①0min~2min 内H2的平均反应速率为_____________________。
②达平衡时,CH4的转化率为_____________;在上述平衡体系中再充入2.00mol甲烷1.00mol 水蒸气,达到新平衡时H2的体积分数与原平衡相比___________(填“变大”、“变小”或“不变”),可判断该反应达到新平衡状态的标志有__________(填字母)。
a.CO的含量保持不变 b.容器中c(CH4)与c(CO)相等
c.容器中混合气体的密度保持不变 d.3υ正(CH4)=υ逆(H2)
(3)合成甲醇工厂的酸性废水中含有甲醇(CH3OH),常用向废液中加入硫酸钴,再用微生物电池电解,电解时Co2+被氧化成Co3+,Co3+把水中的甲醇氧化成CO2,达到除去甲醇的目的。工作原理如图( c为隔膜,甲醇不能通过,其它离子和水可以自由通过):
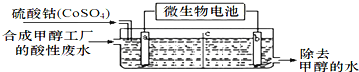
①a电极的名称为__________。
②写出除去甲醇的离子方程式______________________。
③微生物电池是绿色酸性料电池,写出该电池正极的电极反应式为__________________。