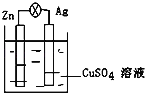
题目内容
【题目】为测试一铁片中铁元素的含量,某课外活动小组提出下面方案并进行了实验。将0.200g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用![]() 的
的![]() 溶液滴定,达到终点时消耗了
溶液滴定,达到终点时消耗了![]() 溶液。
溶液。
(1)配平以下方程式并标出电子转移的方向与数目____________________。
![]()
(2)滴定到终点时的现象为____________________,铁片中铁元素的质量分数为_______________________。
(3)高锰酸钾溶液往往用硫酸酸化而不用盐酸酸化,原因是:_____________。
(4)![]() 溶液呈酸性,加硫酸后
溶液呈酸性,加硫酸后![]() 增加,请结合离子方程式并利用化学平衡移动理论解释:_____________________________。
增加,请结合离子方程式并利用化学平衡移动理论解释:_____________________________。
(5)高锰酸钾在化学品生产中,广泛用作为氧化剂。可以氧化![]() 、
、![]() 、
、![]() 、
、![]() 等多种物质,如
等多种物质,如![]() ,试推测空格上应填物质的化学式为________。
,试推测空格上应填物质的化学式为________。
(6)上述反应在恒温下进行,该过程中会明显看到先慢后快的反应,原因可能是____________________。
【答案】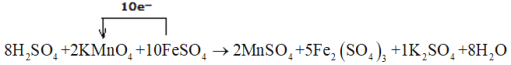 最后加入一滴高锰酸钾,出现紫红色且30s不褪色 70% 盐酸有还原性(或
最后加入一滴高锰酸钾,出现紫红色且30s不褪色 70% 盐酸有还原性(或![]() 有还原性),易被高锰酸钾氧化
有还原性),易被高锰酸钾氧化 ![]() ,加入稀硫酸,增大
,加入稀硫酸,增大![]() 浓度,平衡向左移动,抑制了
浓度,平衡向左移动,抑制了![]() 水解,所以
水解,所以![]() 增大
增大 ![]() 生成的
生成的![]() 可能有催化作用,加快了反应速度
可能有催化作用,加快了反应速度
【解析】
根据氧化还原反应中得失电子守恒配平化学方程式;根据滴定原理分析滴定终点的现象及计算物质的质量分数;根据平衡移动原理及影响速率的因素分析解答。
(1)元素的化合价变化为:Mn:+7→+2,改变数为5,Fe:+2→+3,改变数为1,根据化合价升降的总数相等可知,KMnO4与FeSO4的化学计量数比值为1:5,然后根据质量守恒配平化学方程式,配平后的化学方程式为8H2SO4+2KMnO4+10FeSO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O,电子由Fe转移到Mn: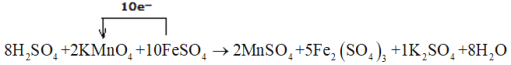 ;
;
(2)高锰酸钾滴入时被亚铁离子还原成无色,则滴定到终点时的现象为最后加入一滴高锰酸钾,出现紫红色且30s不褪色;根据方程式计算得
KMnO4~~~5FeSO4~~~5Fe
1mol 5mol
0.02mol/L×0.025L n
n(Fe)=0.02mol/L×0.025L×5=0.0025mol
则铁片中铁元素的质量分数为![]() ;
;
(3)高锰酸钾有氧化性,盐酸有还原性(或![]() 有还原性),易被高锰酸钾氧化;
有还原性),易被高锰酸钾氧化;
(4)铁离子水解:![]() ,加入稀硫酸,增大
,加入稀硫酸,增大![]() 浓度,平衡向左移动,抑制了
浓度,平衡向左移动,抑制了![]() 水解,所以
水解,所以![]() 增大;
增大;
(5)H2O2中O为-1价,被高锰酸钾氧化后生成O2,故答案为O2;
(6)因为恒温,所以影响反应速率的因素可能是催化剂,故答案为:生成的![]() 可能有催化作用,加快了反应速度。
可能有催化作用,加快了反应速度。

【题目】[2016·新课标I]锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]_______________,有__________个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是______________________________。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因______________________________。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | 49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是______________________________。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为_______________,微粒之间存在的作用力是_______________。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0,![]() );C为(
);C为(![]() ,
,![]() ,0)。则D原子的坐标参数为_______________。
,0)。则D原子的坐标参数为_______________。
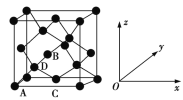
②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a=565.76 pm,其密度为_____g·cm3(列出计算式即可)。