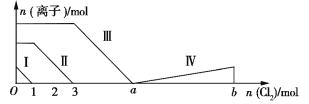
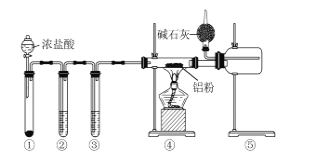
��Ŀ����
����Ŀ��ʵ������Ũ������Ҵ���ȡ��ϩʱ�����ῴ����ƿ��Һ���ڣ��Ƶõ���ϩ�л���CO2��SO2�����ʡ�ij����С�����������װ�ã�֤����ϩ�л���CO2��SO2����֤��ϩ�����ʡ�
�ش��������⣺
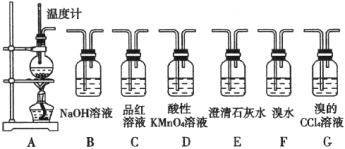
��1��װ��A����ϩ�ķ���װ�á�ͼ��һ�����ԵĴ�����__________����ƿ�����Ƭ��������__________��
��2����Ҫ����A���������庬��SO2���ɽ���Ϻ�����ֱ��ͨ��__________(����ţ���ͬ)װ�ã���Ҫ������A���������庬��CH2=CH2���ɽ����������ͨ��Bװ�ã�Ȼ��ͨ��__________װ�á�
��3��С������A�����Ļ����������ͨ��B��E��D��E������Dǰ���ʯ��ˮ�������Ա仯��D�����ʯ��ˮ����ǡ���Գ��ָ������ԭ����к�������__________��
��4��д��ʵ������ȡ��ϩ�Ļ�ѧ����ʽ__________��
��������1���¶ȼ�ˮ����û�в���Һ�����£�������
��2��C D(��F��G)��3����ϩ�����Ը��������Һ������CO2
��4�� CH3CH2OH![]() CH2=CH2��+H2O
CH2=CH2��+H2O
��������
������1��Ũ������Ҵ���ȡ��ϩʱ��Ӧ�ϸ���Ʒ�Ӧ���Ҵ�Ũ������Һ���¶���170�ȣ������¶ȼƲ������ǻ��Һ���¶ȣ��¶ȼ�ˮ����û�в���Һ�����£��Ҵ��е�ͣ�����ʱ���������У��������Ƭ���Է�ֹ���У��ʴ�Ϊ���¶ȼ�ˮ����û�в���Һ�����£�����ֹ�������У�
��2����A���������庬��SO2����ͨ��ʢ��Ʒ����Һ��C�У�����ʹƷ����Һ��ɫ�������������ͨ��B�������������������ɵĶ�������Ȼ��ͨ��ʢ�����Եĸ�����ص�Dװ�ã������������ɫ���֤����ϩ�Ĵ��ڣ��ʴ�Ϊ��C��D��
��3��Dǰ���ʯ��ˮ�����Ա仯˵���Ҵ�̼�����ɵĶ�����̼�Ͷ������������������գ�D�����ʯ��ˮ����ǣ�˵���������ͨ�뵽���Եĸ�������з�����Ӧ�������ܹ�ʹ����ʯ��ˮ����ǵ����壬����ϩ���в����ͼ����л�ԭ�ԣ��ܱ���������������ʴ�Ϊ����ϩ������KMnO4��Һ������CO2��
��4��ʵ������ȡ��ϩ�Ļ�ѧ����ʽΪCH3CH2OH![]() CH2=CH2��+H2O���ʴ�Ϊ��CH3CH2OH
CH2=CH2��+H2O���ʴ�Ϊ��CH3CH2OH![]() CH2=CH2��+H2O��
CH2=CH2��+H2O��

 ����˼ά�żӿ���ϵ�д�
����˼ά�żӿ���ϵ�д� �����Ծ�ϵ�д�
�����Ծ�ϵ�д�