题目内容
【题目】工业常用燃料与水蒸气反应制备H2和CO,再用H2和CO合成甲醇。
(1)制取H2和CO通常采用:C(s)+H2O(g)CO(g)+H2(g)△H=+131.4kJmol-1,下列判断正确的是_______。
a.该反应的反应物总能量小于生成物总能量
b.标准状况下,上述反应生成1L H2气体时吸收131.4 kJ的热量
c.若CO(g)+H2(g)C(s)+H2O(1)△H=﹣QkJmol-1,则Q<131.4
d.若C(s)+CO2(g)2CO(g)△H1;CO(g)+H2O(g)H2(g)+CO2(g)△H2则:△H1+△H2=+131.4kJmol-1
(2)甲烷与水蒸气反应也可以生成H2和CO,该反应为:CH4(g)+H2O(g)CO(g)+3H2(g)。已知在某温度下2L的密闭绝热容器中充入2.00mol甲烷和1.00mol水蒸气,测得的数据如表:
不同时间各物质的物质的量/mol | ||||
0min | 2min | 4min | 6min | |
CH4 | 2.00 | 1.76 | 1.60 | n2 |
H2 | 0.00 | 0.72 | n1 | 1.20 |
根据表中数据计算:
①0min~2min 内H2的平均反应速率为_____________________。
②达平衡时,CH4的转化率为_____________;在上述平衡体系中再充入2.00mol甲烷1.00mol 水蒸气,达到新平衡时H2的体积分数与原平衡相比___________(填“变大”、“变小”或“不变”),可判断该反应达到新平衡状态的标志有__________(填字母)。
a.CO的含量保持不变 b.容器中c(CH4)与c(CO)相等
c.容器中混合气体的密度保持不变 d.3υ正(CH4)=υ逆(H2)
(3)合成甲醇工厂的酸性废水中含有甲醇(CH3OH),常用向废液中加入硫酸钴,再用微生物电池电解,电解时Co2+被氧化成Co3+,Co3+把水中的甲醇氧化成CO2,达到除去甲醇的目的。工作原理如图( c为隔膜,甲醇不能通过,其它离子和水可以自由通过):

①a电极的名称为__________。
②写出除去甲醇的离子方程式______________________。
③微生物电池是绿色酸性料电池,写出该电池正极的电极反应式为__________________。
【答案】ad 0.18mol·L﹣1·min﹣1 20% 变小 ad 阳极 6Co3++CH3OH+H2O=6Co2++CO2↑+6H+ O2+4e-+4H+=2H2O
【解析】
(1)a、反应是吸热反应,生成物能量总和大于反应物能量总和,故a正确;
b、上述反应生成1mol H2时吸收131.4 kJ的热量,故b错误;
c、根据“C(s)+H2O(g)CO(g)+H2(g)H=+131.4kJmol-1”,CO(g)+H2(g)C(s)+H2O(g)△H=﹣131.4kJmol-1,H2O(g)→H2O(l)放出热量,则CO(g)+H2(g)C(s)+H2O(1)△H=﹣QkJmol-1,Q>131.4,故c错误;
d、若C(s) + CO2(g) 2CO(g) △H1;CO(g) + H2O(g) H2(g) + CO2(g) △H2,根据盖斯定律,则:△H1 + △H2 =+131.4 kJmol-1,故d正确;
答案选ad。
(2)①0min~2min 内H2的平均反应速率为![]() =0.18mol·L﹣1·min﹣1;
=0.18mol·L﹣1·min﹣1;
②4min时,参加反应的甲烷为2mol﹣1.6mol=0.4mol,生成氢气为0.4mol×3=1.2mol,与6min时相等,说明4min时反应已经达到平衡,此时甲烷的转化率为![]() ×100%=20%;在上述平衡体系中再充入2.00mol甲烷和1.00mol 水蒸气,相当于增大压强,平衡向逆反应方向移动,达到新平衡时H2的体积分数与原平衡相比变小;
×100%=20%;在上述平衡体系中再充入2.00mol甲烷和1.00mol 水蒸气,相当于增大压强,平衡向逆反应方向移动,达到新平衡时H2的体积分数与原平衡相比变小;
a.CO的含量保持不变,反应达到平衡;
b.容器中c(CH4)与c(CO)相等,不一定平衡;
c.容器中混合气体的密度一直不变,不是平衡状态的标志;
d.3υ正(CH4)=υ逆(H2),是反应达到平衡的本质标志;
答案选ad。
(3)①电极a,Co2+被氧化成Co3+,发生氧化反应,为电解池的阳极;
②甲醇被氧化生成二氧化碳,Co3+被还原生成Co2+,溶液呈酸性,则生成物中含有氢离子,所以该反应离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;
③微生物电池是绿色酸性燃料电池,氧气在正极发生得电子的还原反应,正极的电极反应式为4H++O2+4e-=2H2O。

 53随堂测系列答案
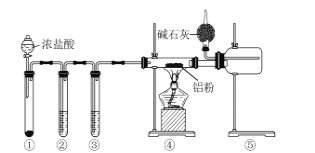
53随堂测系列答案【题目】某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应。其中A、F为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置。
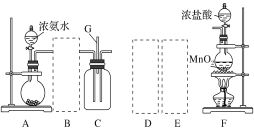
请回答下列问题:
(1)装置A中的烧瓶内固体可选用________(填字母)。
A.碱石灰 B.浓硫酸 C.生石灰 D.五氧化二磷 E.烧碱
(2)虚线框内应添加必要的除杂装置,请从如图的备选装置中选择,并将编号填入下列空格:
备选装置 | ||
|
|
|
Ⅰ | Ⅱ | Ⅲ |
B:________、D:________、E:________。
(3)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,该反应的化学方程式为:_______
(4)装置C内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案确定该白色固体中的阳离子:________________