题目内容
【题目】在智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘,其化学方程式是2NaIO3+5NaHSO3===3NaHSO4+2Na2SO4+I2+H2O
(1)反应中______元素被氧化,_______是氧化剂。
(2)用“双线桥”标出电子转移的方向和数目。_________。
(3)反应产物中,氧化产物与还原产物的物质的量之比为__________。
【答案】S NaIO3 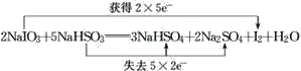 5∶1
5∶1
【解析】
(1)根据氧化剂:化合价降低,得电子,被还原;还原剂:化合价升高,失电子,被氧化判断;
(2)双线桥法注意箭头方向由氧化剂指向还原产物,还原剂指向氧化产物,在箭头上方标出得失电子数;
(3)根据还原剂生成氧化产物,氧化剂生成还原产物,确定氧化产物和还原产物,再根据方程式判断物质的量之比。
(1)结合方程式中元素化合价发生的变化可知,NaIO3中碘元素化合价降低,作氧化剂,被还原为I2;硫元素化合价升高,被氧化为NaHSO4和Na2SO4;
答案:S ;NaIO3
(2)结合各物质的化学计量数计算转移的电子数目,标注电子转移,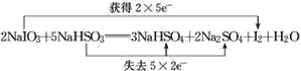 ;
;
答案:
(3)氧化产物为NaHSO4和Na2SO4共5 mol,还原产物为1 mol I2,氧化产物与还原产物的物质的量之比为5∶1;
答案:5∶1

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目