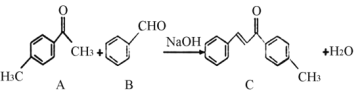
题目内容
【题目】S2O82-具有强氧化性,其还原产物为SO42-,硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生反应,得到紫红色溶液。请写出此反应的化学方程式:__。
【答案】5K2S2O8+2MnSO4+8H2O![]() 4K2SO4+2KMnO4+8H2SO4
4K2SO4+2KMnO4+8H2SO4
【解析】
依据题意可知反应物为硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液,生成物为高锰酸钾、硫酸钾和硫酸,利用质量守恒定律和电子守恒来写出并配平上述反应的化学方程式。
K2S2O8+MnSO4+H2O→K2SO4+KMnO4+H2SO4反应中MnSO4的锰元素由+2价升高到KMnO4中的+7价,化合价升高5,K2S2O8的中+7的硫降为硫酸根中+6价的硫,化合价降1,依据氧化还原反应中化合价升高和降低数目相等结合原子个数守恒,配平方程式中氧化剂、还原剂、氧化产物和还原产物的化学计量数,然后根据元素守恒配平相应物质的化学计量数。其反应方程式为:5K2S2O8+2MnSO4+8H2O![]() 4K2SO4+2KMnO4+8H2SO4
4K2SO4+2KMnO4+8H2SO4
故答案为:5K2S2O8+2MnSO4+8H2O![]() 4K2SO4+2KMnO4+8H2SO4;
4K2SO4+2KMnO4+8H2SO4;

练习册系列答案
相关题目