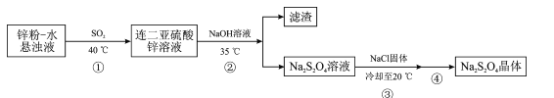
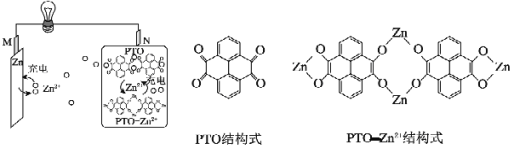
题目内容
【题目】对于反应3Cl2+6NaOH![]() 5NaCl+NaClO3+3H2O,以下叙述正确的是( )
5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A.Cl2是氧化剂,NaOH是还原剂
B.被氧化的氯原子和被还原的氯原子的物质的量之比为5∶1
C.Cl2既做氧化剂又做还原剂
D.氧化剂得电子数与还原剂失电子数之比为5∶1
【答案】C
【解析】
A.反应中只有Cl元素的化合价变化,Cl2既做氧化剂又做还原剂,故A错误;
B.由反应可知,1个Cl原子失去电子,被氧化,5个Cl原子得到电子被还原,被氧化的氯原子和被还原的氯原子的物质的量之比为1∶5,故B错误;
C. 反应中只有Cl元素的化合价变化,Cl2既做氧化剂又做还原剂,故C正确;
D.氧化还原反应中电子得失守恒,氧化剂得电子数与还原剂失电子数相等,为1∶1,故D错误;
答案:C。

练习册系列答案
相关题目