题目内容
【题目】化学平衡原理在工农业生产中发挥着重要的指导作用。
(1)反应C(s)+CO2(g)![]() 2CO(g)平衡常数K的表达式:K=___;
2CO(g)平衡常数K的表达式:K=___;
(2)已知某温度下,反应2SO2(g)+O2(g)![]() 2SO3(g),的平衡常数K=19。在该温度下的体积固定的密闭容器中充入c(SO2)=1mol·L-1,c(O2)=1 mol·L-1,当反应在该温度下SO2转化率为80%时,该反应___(填“是”或“否”)达到化学平衡状态,若未达到,向___(填“正反应”或“逆反应”) 方向进行。
2SO3(g),的平衡常数K=19。在该温度下的体积固定的密闭容器中充入c(SO2)=1mol·L-1,c(O2)=1 mol·L-1,当反应在该温度下SO2转化率为80%时,该反应___(填“是”或“否”)达到化学平衡状态,若未达到,向___(填“正反应”或“逆反应”) 方向进行。
(3)对于可逆反应:aA(g) +bB(g)![]() cC(g)+dD(g) △H = m kJ·mol-1;若a+b>c+d,增大压强平衡向___(填“正反应”或“逆反应”)方向移动;若升高温度,平衡向逆反应方向移动,则m___0(填“>”或“<”)
cC(g)+dD(g) △H = m kJ·mol-1;若a+b>c+d,增大压强平衡向___(填“正反应”或“逆反应”)方向移动;若升高温度,平衡向逆反应方向移动,则m___0(填“>”或“<”)
(4)在一定条件下,A气体与B气体反应生成C气体。反应过程中,反应物与生成物的浓度随时间变化的曲线如图,则
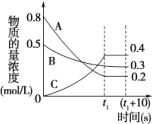
①该反应的化学方程式为:___;
②t1s时反应物A的转化率为:___;
③0~t1s内A的反应速率为v(A)=___。
【答案】![]() 否 逆反应 正反应 < 3A+B
否 逆反应 正反应 < 3A+B![]() 2C 75%
2C 75% ![]() mol/(L·s)
mol/(L·s)
【解析】
(1)化学平衡常数,是指在一定温度下,达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
(2)根据三段式计算出SO2转化率为80%时,各组分的浓度,计算浓度商Qc,根据浓度商与平衡常数的关系,判断是否处于平衡状态或平衡的移动方向,Qc=K,处于平衡状态,Qc>K反应向逆反应进行,Qc<K反应向正反应进行;
(3)增大压强平衡向气体体积减小的方向移动;升高温度,平衡向逆反应方向移动,说明正反应是放热反应;
(4)①由图象可知,在反应中,A、B的浓度逐渐减小,C的浓度逐渐增大,则A、B为反应物,C为生成物,t1 s时A、B浓度不变且不为0,说明是可逆反应,化学反应中浓度变化之比等于化学计量数之比,进而书写反应方程式;
②A的转化率=![]() ×100%;
×100%;
③根据![]() 计算v(A)。
计算v(A)。
(1)反应C(s)+CO2(g)![]() 2CO(g)的平衡常数K=
2CO(g)的平衡常数K=![]() ;
;
(2)该温度下SO2转化率为80%时,△c(SO2)=1molL1×80%=0.8 mol·L-1,则:
2SO2(g)+O2(g)2SO3(g),
开始(mol·L-1): 1 1 0
变化(mol·L-1): 0.8 0.4 0.8
SO2转化率为80%时(mol·L-1): 0.2 0.6 0.8
所以浓度商Qc=![]() =26.7>19,该反应未达平衡状态,反应向逆反应进行,故答案为:否;逆反应;
=26.7>19,该反应未达平衡状态,反应向逆反应进行,故答案为:否;逆反应;
(3)增大压强平衡向气体体积减小的方向移动,由于a+b>c+d,故平衡向正反应移动;升高温度,平衡向逆反应方向移动,说明正反应是放热反应,即m<0,
故答案为:正反应;<;
(4)①由图象可知,在反应中,A、B的浓度逐渐减小,C的浓度逐渐增大,则A、B为反应物,C为生成物,t1 s时A、B浓度不变且不为0,说明是可逆反应,t1 s内△c(A):△c(B):△c(C)=(0.8-0.2):(0.5-0.3):0.4=3:1:2,化学反应中浓度变化之比等于化学计量数之比,则化学方程式为3A+B![]() 2C;
2C;
(2)t1 s时反应物A的浓度变化量为(0.8-0.2)mol/L=0.6mol/L,A的转化率=![]() ×100%=75%,故答案为:75%;
×100%=75%,故答案为:75%;
(3)0~t1s内A的浓度变化量为(0.8-0.2)mol/L=0.6mol/L,则v(A)= mol/(L·s),故答案为:![]() mol/(L·s)
mol/(L·s)