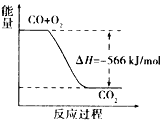
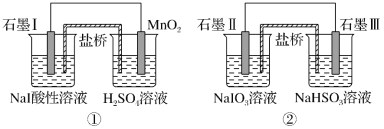
题目内容
【题目】将500 mL 0.1mol·L-1CuSO4和1 mol·L-1NaC1混合溶液,用石墨为电极电解。一段时间后在阳极收集到4.48 L(标况下)气体,溶液体积几乎没有变化。
计算: (已知:lg2=0.3,lg3=0.5)
(1)阴极析出铜的质量为多少克?__________
(2)计算电解后溶液的pH__________
【答案】3.2g 13.8
【解析】
溶液中所含离子为Cu2+、Na+、H+、SO42-、Cl-、OH-,电解池中阳极发生氧化反应,氯离子先于氢氧根放电,发生反应2Cl--2e-==Cl2↑,当氯离子完全反应后,氢氧根放电发生反应:4OH--4e-==O2↑+4H+;阴极发生还原反应,铜离子先于氢离子放电,发生Cu2++2e-==Cu,当铜离子完全反应后,氢离子放电发生反应:2H++2e-==H2↑;
(1)溶液中n(Cl-)=cV=0.5L×1 mol·L-1=0.5mol,完全反应可生产n(Cl2)=0.25mol,标况下的体积V(Cl2)=nVm=0.25mol×22.4L·mol-1=5.6L,所以当阳极收集到4.48 L(标况下)气体时,溶液中的氯离子未完全反应,阳极只发生2Cl--2e-==Cl2,4.48L氯气的物质的量为0.2mol,根据电极方程式可知转移电子为0.4mol;溶液中的n(Cu2+)= cV=0.5L×0.1 mol·L-1=0.05mol,根据阴极方程式Cu2++2e-==Cu可知,当铜离子完全反应时转移0.1mol电子,所以当转移0.4mol电子时铜离子已完全反应,即生成铜单质的物质的量为0.05mol,铜单质的质量=nM=0.05mol×64g·mol-1=3.2g,故答案为:3.2g;
(2)根据(1)可知当当阳极收集到4.48 L(标况下)气体时,转移0.4mol电子,且铜离子完全反应,铜离子完全反应后,阴极发生反应2H++2e-==H2,且该过程转移0.4mol-0.1mol=0.3mol电子,根据电极方程式可知消耗0.3mol氢离子,该溶液中氢离子由水电离产生,消耗0.3mol氢离子,则产生0.3mol氢氧根,所以此时溶液中c(OH-)=![]() ,则溶液中c(H+)=
,则溶液中c(H+)=![]() ,pH=-lg c(H+)= 13.8,故答案为:13.8;
,pH=-lg c(H+)= 13.8,故答案为:13.8;

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案【题目】下列各组物质中,不能按![]() (“→”表示一步完成)的关系相互转化的是 ( )
(“→”表示一步完成)的关系相互转化的是 ( )
选项 | a | b | c |
A | Fe | FeCl3 | FeCl2 |
B | Cl2 | NaClO | NaCl |
C | Si | SiO2 | H2SiO3 |
D | HNO3 | NO | NO2 |
A.AB.BC.CD.D