题目内容
【题目】已知: 2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+ ![]() O2(g)△H=-226kJ/mol
O2(g)△H=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
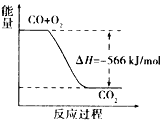
A. CO 的燃烧热为566kJ/mol
B. 上图可表示由CO生成CO2的反应过程和能量关系
C. 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) △H<-452 kJ/mol
D. CO2(g)与Na2O2(s)反应放出452kJ 热量时,电子转移数为1.204×1024 (个)
【答案】D
【解析】A. 燃烧热对应1mol可燃物,CO的燃烧热为283kJ/mol,故A错误;B. 上图不能表示由CO生成CO2的反应过程,故B错误;C. CO2(g)=CO2(s) △H<0,所以2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) △H>-452kJ/mol,故C错误;D. CO2(g)与Na2O2(s)反应放出452kJ热量时,电子转移2mol,电子转移数为1.204×1024(个),故D正确。故选D。

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目