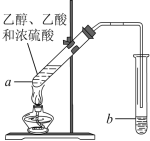
题目内容
【题目】氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域.在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C![]() 2AlN+3CO.下列叙述正确的是( )
2AlN+3CO.下列叙述正确的是( )
A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中每生成2 mol AlN,N2得到3 mol电子
C.氮化铝中氮元素的化合价为﹣3
D.氮化铝晶体属于分子晶体
【答案】C
【解析】
试题分析:在一定条件下,合成氮化铝的反应为Al2O3+N2+3C![]() 2AlN+3CO.反应中氮、碳元素化合价变化,Al、O元素的化合价不变,AlN中N的化合价为﹣3价.
2AlN+3CO.反应中氮、碳元素化合价变化,Al、O元素的化合价不变,AlN中N的化合价为﹣3价.
解:A.根据氧化还原反应的规律:(还原剂)升(化合价升高) 失(失去电子) 氧(发生氧化反应);(氧化剂)降(化合价降低) 得(得到电子) 还(发生还原反应)若说剂正相反.可以分析出,在氮化铝的合成反应中,N2的化合价由0→﹣3,发生改变,N2是氧化剂;Al2O3 中Al、O元素的化合价不变,既不是氧化剂也不是还原剂.故A错误;
B.在氮化铝的合成反应中,N2的化合价由0→﹣3,每生成2 mol AlN,N2得到的电子是3×2=6mol电子.故B错误;
C.氮化铝中Al的化合价为+3价,氮元素的化合价为﹣3价.故C正确;
D.氮化铝晶体是由Al3+和N3﹣构成的离子化合物.故D错误;
故选C.

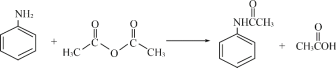
【题目】酰苯胺作为一种常用药,具有解热镇痛的效果。实验室制备乙酰苯胺时,可以用苯胺与乙酸酐或与冰醋酸加热来制取,苯胺与乙酸酐的反应速率远大于与冰醋酸反应的速率,现选用苯胺与乙酸酐为原料制取和提纯乙酰苯胺,该放热反应的原理:
密度(g/mL) | 相对分子质量 | 颜色、状态 | 溶解性 | |
苯胺 | 1.04 | 93 | 无色油状液体 | 微溶于水, 易溶于乙醇、乙醚 |
乙酸酐 | 1.08 | 102 | 无色透明液体 | 遇水缓慢反应生成乙酸 |
乙酰苯胺 | 135 | 无色片状晶体, 熔点 114℃ | 不溶于冷水,可溶于热 水、乙醇、乙醚 |
实验步骤
①取 5.00mL 苯胺,倒入 100mL 锥形瓶中,加入 20mL 水,在旋摇下分批加入 6.00mL 乙酸酐,搅拌均匀。若有结块现象产生,用玻璃棒将块状物研碎,再充分搅拌;
②反应完全后,及时把反应混合物转移到烧杯中,冷却后,抽滤,洗涤,得粗乙酰苯胺固体;
③将粗产品转移至 150mL 烧杯中,加入适量水配制成 80℃的饱和溶液,再加入过量 20%的水。稍冷后,加半匙活性炭,搅拌下将溶液煮沸 3~5min,趁热过滤,冷却结晶,抽滤、洗涤、晾干得乙酰苯胺纯品。
请回答:
(1)苯胺与冰醋酸反应制备乙酰苯胺的化学反应方程式____________________________________。
(2)反应温度过高会导致苯胺挥发,下列操作可控制反应温度,防止反应温度升高过快的是____________。
A.反应快结束时的充分搅拌 B.旋摇下分批加入 6.0mL 乙酸酐
C.玻璃棒将块状物研碎 D.加 20mL 水
(3)在步骤②中对粗产品进行洗涤可能需要用到以下操作:a.加入洗涤剂至浸没固体;b. 洗涤剂缓慢通过;c.洗涤剂快速通过;d.关小水龙头;e.开大水龙头;f.重复 2~3 次。请选出正确的操作并排序_____。(操作可重复使用)
(4)加入过量 20%的水的目的是_____。
(5)下列关于步骤③说法不正确的是__________________________。
A. 活性炭吸附有色物质,可以提高产率
B. 冷却时,冰水浴冷却比室温冷却更易得到大颗粒晶体便于抽滤
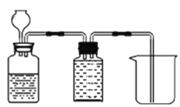
C. 抽滤用如图装置,为防止倒吸,结束时可先关闭抽气泵,后打开活塞 a
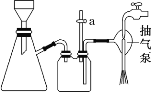
D. 洗涤完成后应将布氏漏斗从吸滤瓶上取下,左手握布氏漏斗,倒转,用右手“拍击”左手, 使固体连同滤纸一起落入洁净的表面皿上,揭去滤纸,再对固体做晾干处理
(6)最后测得纯乙酰苯胺固体 5.40g,该实验的产率为_____(保留三位有效数字)。