题目内容
【题目】甲醇是一种重要的化工原料,有着重要的用途和应用前景。请回答下列问题:
(1)工业生产甲醇的常用方法是CO(g)+2H2(g)![]() CH3OH(g) ΔH=-90.8 kJ·mol-1。
CH3OH(g) ΔH=-90.8 kJ·mol-1。
已知:2H2(g)+O2(g)==2H2O(l) ΔH=-571.6 kJ·mol-1;
2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ·mol-1;
CH3OH(g)=CH3OH(l) ΔH=-37.3 kJ·mol-1。
计算液体CH3OH的燃烧热为_______________。
(2)甲醇不完全燃烧产生的CO可利用I2O5来除去,其反应为5CO(g)+I2O5(s)![]() 5CO2(g) +I2(s)。不同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得的CO2体积分数随着时间t变化曲线如图所示。则:
5CO2(g) +I2(s)。不同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得的CO2体积分数随着时间t变化曲线如图所示。则:

①T2温度时,0~0.5 min的反应速率v(CO)=___________。
②T1温度时,反应达到平衡,CO的转化率为_______,化学平衡常数K=_______(用具体数值表示)。
③下列说法正确的是_________(填编号)。
A.容器内压强不变,表明反应达到平衡状态
B.容器内气体密度不变,表明反应达到平衡状态
C.单位时间内,消耗a mol CO,同时消耗2a mol CO2, 表明反应v(正)<v(逆)
D.两种温度下,c点时体系中混合气体的压强相等
E.反应5CO(g)+I2O5(s)![]() 5CO2(g)+I2(s)为吸热反应
5CO2(g)+I2(s)为吸热反应
【答案】726.5 kJ·mol-1 0.8 mol·L-1·min-1 80% 1024 BC
【解析】
(1)根据盖斯定律进行计算。
(2)①先计算CO2物质的量,再计算CO2的速率,再计算CO的反应速率。
②先计算CO2物质的量,再计算CO改变量,再算CO的转化率和化学平衡常数。
③根据化学平衡判断的标志和改变条件对平衡的移动进行分析。
(1)根据盖斯定律,第2个方程式加第3个方程,减去第1个方程,再减去第4个方程得到CH3OH(l) +2O2(g) =2H2O(l) +CO2(g) ΔH=-726.5 kJ·mol-1,因此液体CH3OH的燃烧热为726.5 kJ·mol-1;
故答案为:726.5 kJ·mol-1。
(2)①5CO(g)+I2O5(s)![]() 5CO2(g) +I2(s),该反应是等体积反应,只有CO、CO2为气体,T2温度时,CO2物质的量为2×0.4 =0.8mol,0~0.5 min的反应速率
5CO2(g) +I2(s),该反应是等体积反应,只有CO、CO2为气体,T2温度时,CO2物质的量为2×0.4 =0.8mol,0~0.5 min的反应速率![]() ,CO的反应速率为0.8 mol·L-1·min-1;
,CO的反应速率为0.8 mol·L-1·min-1;
故答案为:0.8 mol·L-1·min-1;
②T1温度时,CO2物质的量为2×0.8 =1.6 mol,CO改变量为1.6 mol,CO的转化率为![]() ,化学平衡常数
,化学平衡常数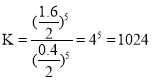 ;
;
故答案为:80%;1024;
③A选项,该反应是等体积反应,容器内压强始终不变,不能做为反应达到平衡状态的标志,故A不符合题意;
B选项,反应正向移动,气体质量增加,容器体积不变,密度增大,因此容器内气体密度不变,表明反应达到平衡状态,故B符合题意;
C选项,单位时间内,消耗a mol CO,同时消耗2a mol CO2,表明反应v(正)<v(逆),平衡逆向移动,故C正确;
D选项,两种温度下,T2温度高,因此c点时体系中混合气体的压强,T2曲线上压强大,故D不符合题意;
E选项,根据图像,从下到上,温度降低,平衡正向移动,反应为放热反应,故E不符合题意;
综上所述,答案为BC。