题目内容
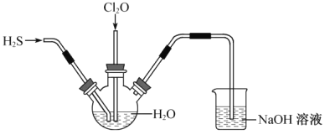
【题目】如图是利用盐桥电池从某些含碘物质中提取碘的两个装置,下列说法中正确的是( )
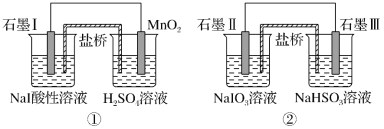
A.两个装置中,石墨I和石墨Ⅱ均作负极
B.碘元素在装置①中被还原,在装置②中被氧化
C.装置①中MnO2的电极反应式为MnO2+2H2O+2e-=Mn2++4OH-
D.装置①、②中的反应生成等量的I2时,导线上通过的电子数之比为1∶5
【答案】D
【解析】
根据题中利用盐桥电池从某些含碘物质中提取碘可知,本题考查原电池知识,运用原电池工作原理分析。
A.装置①中碘离子失去电子,石墨I为负极;装置②中碘酸钠得电子,石墨Ⅱ作正极,所以两个装置中石墨I做负极而石墨Ⅱ作正极,A项错误;
B.装置①中碘离子失去电子,被氧化;在装置②中碘酸钠得电子被还原,B项错误;
C.酸性介质中不可能生成氢氧根离子,所以装置①中MnO2的电极反应式为:MnO2+4H++2e-=Mn2++2H2O,C项错误;
D.装置①中碘离子失去电子,1mol碘化钠失去1mol电子;装置②中碘酸钠得电子,1mol 碘酸钠得到5mol的电子,所以反应②中生成等量的I2时,导线上通过的电子数之比为1:5, D项正确;
答案选D。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案【题目】三硫代碳酸钠(Na2CS3)常用作杀菌剂、沉淀剂。某小组设计实验探究三硫代碳酸钠的性质并测定其溶液的浓度。
实验1:探究Na2CS3的性质
步骤 | 操作及现象 |
① | 取少量Na2CS3 固体溶于蒸馏水配制成溶液并分成两等份 |
② | 向其中一份溶液中滴加几滴酚酞试液,溶液变红色 |
③ | 向另一份溶液中滴加酸性KMnO4溶液,紫色褪去 |
(1)H2CS3是________酸(填“强”或“弱”)。
(2)已知步骤③的氧化产物是SO42-,写出该反应的离子方程式________________________。
实验2:测定Na2CS3溶液的浓度,按如图所示连接好装置,取100mLNa2CS3溶液置于三颈烧瓶中,打开仪器d的活塞,滴入足量2.0mol/L稀H2SO4,关闭活塞。
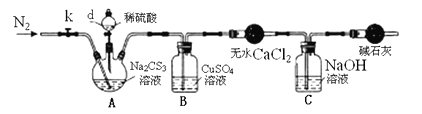
已知:Na2CS3 + H2SO4=Na2SO4 + CS2 + H2S↑。CS2和H2S均有毒。CS2不溶于水,沸点46℃,与CO2某些性质相似,与NaOH作用生成Na2COS2和H2O。
(3)盛放无水CaCl2的仪器的名称是____________。
(4)反应结束后打开活塞k,再缓慢通入热N2一段时间,其目的是___________________。
(5)为了计算Na2CS3溶液的浓度,对B中混合物进行过滤、洗涤、干燥、称重,得19.2g固体,则A中Na2CS3的物质的量浓度为____________________。
(6)分析上述实验方案,还可以通过测定C中溶液质量的增加值来计算Na2CS3溶液的浓度,若反应结束后将通热N2改为通热空气,计算值________(填“偏高”、“偏低”或“无影响”)。
【题目】为测定![]() 样品的纯度,用硫酸溶解6.300 g样品,定容至250 mL。取25.00 mL溶液,用
样品的纯度,用硫酸溶解6.300 g样品,定容至250 mL。取25.00 mL溶液,用![]() 标准溶液滴定至终点。重复实验,数据如下:
标准溶液滴定至终点。重复实验,数据如下:
序号 | 滴定前读数/mL | 滴定终点读数/mL |
1 | 0.00 | 19.98 |
2 | 1.26 | 22.40 |
3 | 1.54 | 21.56 |
已知:![]()
假设杂质不参加反应。
该样品中![]() 的质量分数是________%(保留小数点后一位);
的质量分数是________%(保留小数点后一位);
写出简要计算过程:________。