题目内容
19. 2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.
2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.Ⅰ实验制备:
实验原理:2Na2CO3+3H2O2═2Na2CO3•3H202
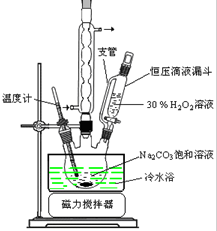
实验步骤:取3.5gNa2CO3溶于10mLH2O加入0.1g稳定剂,用磁力搅拌器搅拌完全溶解后,将6.0mL30%H2O2在15min内缓慢加入到三颈烧瓶中,实验装置如图.
反应1小时后,加入1g氯化钠后,静置结晶,然后抽滤,干燥一周后,称重.
(1)装置中球形冷凝管的作用是冷凝回流;
(2)使用冷水浴的作用是降低温度,防止2Na2CO3•3H2O2分解;
(3)加入适量NaCl固体的原因是降低2Na2CO3•3H2O2的溶解度,利用晶体析出;
(4)2Na2CO3•3H2O2极易分解,其反应方程式可表示为2(2Na2CO3•3H2O2)═4Na2CO3+6H2O+3O2↑.
Ⅱ、活性氧含量测定
准确称取试样0.2000g,置于250mL锥形瓶中,加100mL浓度为6%的硫酸溶液,用0.0200mol/L高锰酸钾标准溶液滴定,记录高锰酸钾标准溶液消耗的体积为32.70mL.
活性氧含量计算公式:Q%=(40$\frac{cV}{m}$)×100%[c--KMnO2标准溶液浓度(mol/L);V--消耗的KMnO4标准溶液体积(L);m--试样质量(g)]
(5)滴定终点的判定依据为加入最后一滴高锰酸钾溶液,溶液紫色不褪去;
(6)滴定过程中涉及的化学方程式6KMnO4 +5(2Na2CO3•3H2O2)+19H2SO4=3K2SO4+6MnSO4 +10Na2SO4 +10CO2↑+15O2↑+34H2O;
(7)活性氧含量为13.8%.
分析 (1)过氧化氢与水易形成蒸汽,需要进行冷凝回流;
(2)到达一定温度,2Na2CO3•3H2O2易分解;
(3)加入氯化钠后,静置结晶得到2Na2CO3•3H2O2,起盐析作用,降低了产品的溶解度;
(4)既有碳酸盐的性质,又有双氧水的不稳定性和氧化性,分解得到碳酸钠、氧气与水;
(5)反应实质是过氧化氢与高锰酸钾发生氧化反应反应,当过氧化氢反应完毕,加入的高锰酸钾溶液颜色不褪去;
(6)可以看作碳酸钠与硫酸反应、高锰酸钾在酸性条件下与过氧化氢反应,整个生成硫酸钠、硫酸钾、硫酸锰、二氧化碳、氧气与水;
(7)根据活性氧含量计算公式,代入数据计算.
解答 解:(1)由制备装置中使用冷水浴,可知反应应放出热量,过氧化氢与水易形成蒸汽,需要进行冷凝回流,减少过氧化氢的损失,
故答案为:冷凝回流;
(2)到达一定温度,2Na2CO3•3H2O2易分解,利用冷水浴,降低温度,防止2Na2CO3•3H2O2分解,
故答案为:降低温度,防止2Na2CO3•3H2O2分解;
(3)加入氯化钠后,静置结晶得到2Na2CO3•3H2O2,起盐析作用,降低了产品的溶解度,
故答案为:降低2Na2CO3•3H2O2的溶解度,利用晶体析出;
(4)既有碳酸盐的性质,又有双氧水的不稳定性和氧化性,分解得到碳酸钠、氧气与水,分解反应方程式为:2(2Na2CO3•3H2O2)═4Na2CO3+6H2O+3O2↑,
故答案为:2(2Na2CO3•3H2O2)═4Na2CO3+6H2O+3O2↑;
(5)反应实质是过氧化氢与高锰酸钾发生氧化反应反应,当过氧化氢反应完毕,加入最后一滴高锰酸钾溶液,溶液紫色不褪去,说明滴定到终点,
故答案为:加入最后一滴高锰酸钾溶液,溶液紫色不褪去;
(6)可以看作碳酸钠与硫酸反应、高锰酸钾在酸性条件下与过氧化氢反应,整个生成硫酸钠、硫酸钾、硫酸锰、二氧化碳、氧气与水,滴定过程中反应方程式为:6KMnO4 +5(2Na2CO3•3H2O2)+19H2SO4=3K2SO4+6MnSO4 +10Na2SO4 +10CO2↑+15O2↑+34H2O,
故答案为:6KMnO4 +5(2Na2CO3•3H2O2)+19H2SO4=3K2SO4+6MnSO4 +10Na2SO4 +10CO2↑+15O2↑+34H2O;
(7)根据活性氧含量计算公式:Q%=(40$\frac{cV}{m}$)×100%,可知活性氧含量为(40×$\frac{0.0327×0.02}{0.2}$)×100%=13.8%,
故答案为:13.8%.
点评 本题考查制备方案、实验条件控制分析、氧化还原反应滴定等,是对学生综合能力的考查,难度中等,注意从Na2CO3和H2O2的双重性质理解发生的反应.

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案| A. | K[Ag(CN)2]、[Cu(NH3)4]SO4 | B. | [Ni(NH3)4]Cl2、[Ag(NH3)2]Cl | ||
| C. | [Ag(NH3)2]Cl、[Cu(NH3)2]Cl2 | D. | [Ni(NH3)4]Cl2、[Cu(NH3)4]SO4 |
| A. | MgSO4 | B. | FeCl2 | C. | AlCl3 | D. | NaAlO2 |
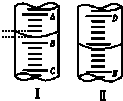 如图,图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度间相差1mL,图II表示50mL滴定管中液面的位置,D与E刻度间相差1mL.如果刻度A和D都是10,则两处液面的读数是( )
如图,图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度间相差1mL,图II表示50mL滴定管中液面的位置,D与E刻度间相差1mL.如果刻度A和D都是10,则两处液面的读数是( )| A. | Ⅰ中是9.2 mL,Ⅱ中是9.40 mL | B. | Ⅰ中是10.8 mL,Ⅱ中是9.40 mL | ||
| C. | Ⅰ中是9.2 mL,Ⅱ中是10.60 mL | D. | Ⅰ中是10.8 mL,Ⅱ中是10.60 mL |