题目内容
8.在下列晶体中,一定存在共价键的是( )| A. | 离子晶体 | B. | 分子晶体 | C. | 原子晶体 | D. | 金属晶体 |
分析 A、离子晶体是由阴、阳离子通过离子键形成的晶体.
B、稀有气体是单原子分子.
C、原子间通过共价键形成的空间网状结构的晶体属于原子晶体.
D、金属晶体由金属阳离子与自由电子构成.
解答 解:A、离子晶体是由阴、阳离子通过离子键形成的晶体,离子晶体中一定含有离子键,可能含有共价键,故A错误;
B、分子晶体一般含有共价键,但稀有气体是单原子分子,不存在化学键,故B错误;
C、原子间通过共价键形成的空间网状结构的晶体属于原子晶体,原子晶体中一定含有共价键,故C正确;
D、金属晶体由金属阳离子与自由电子构成,金属晶体中一定不含有共价键,故D错误.
故选:C.
点评 本题考查晶体构成微粒间作用力,难度不大,注意常见物质晶体类别与微粒间作用,注意B、D选项的特殊性.

练习册系列答案
相关题目
9.向10mL 1mol•L-1 AlCl3溶液中加入1mol•L-1 NaOH溶液,得到沉淀0.26g,则刚加入的NaOH溶液的体积可能为( )
| A. | 10mL 20mL | B. | 20mL 30mL | C. | 10mL 36.7mL | D. | 20mL 36.7mL |
16.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 水电离出的c(H+)=1.0×10-13mol/L的溶液中,Na+、NH4+、Cl-、SO42- | |
| B. | 滴入甲基橙试液变红色的溶液中:Cl-、AlO2-、HCO3-、NH4+ | |
| C. | 加入少量KSCN后变为红色的溶液中:K+、Mg2+、I-、NO3- | |
| D. | 无色透明的溶液中:CH3COO-、CO32-、K+、Na+ |
3.已知:①2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1
②N2(g)+2O2(g)═2NO2(g)△H=+67.8kJ•mol-1
③N2(g)+3H2(g)═2NH3(g)△H=-92.0kJ•mol-1
则4NH3(g)+7O2(g)═4NO2(g)+6H2O(g)△H=XkJ•mol-1中X的值是( )
②N2(g)+2O2(g)═2NO2(g)△H=+67.8kJ•mol-1
③N2(g)+3H2(g)═2NH3(g)△H=-92.0kJ•mol-1
则4NH3(g)+7O2(g)═4NO2(g)+6H2O(g)△H=XkJ•mol-1中X的值是( )
| A. | -1131.2 | B. | -647.6 | C. | -507.8 | D. | -323.8 |
13.COCl2俗称光气,其中心C原子采用sp2杂化成键.下列对该分子结构的分子中错误的是( )
| A. | 分子中所有原子共平面 | B. | 碳氧原子之间含有1个α键和1个π键 | ||
| C. | 分子中既含单键又含双键 | D. | 分子中既含极性键又含非极性键 |
20.下列说法正确的是( )
| A. | 1 mol苯甲酸在浓H2SO4存在下与足量乙醇反应可得1 mol苯甲酸乙酯 | |
| B. | 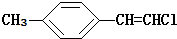 分子中的所有原子有可能共平面 分子中的所有原子有可能共平面 | |
| C. | 分子式为C5H12O的醇,能在铜催化下被O2氧化为醛的同分异构体有4种 | |
| D. | 1 mol阿司匹林(结构简式见图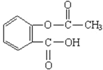 )与足量的氢氧化钠溶液加热反应,最多消耗的氢氧化钠的物质的量2 mol )与足量的氢氧化钠溶液加热反应,最多消耗的氢氧化钠的物质的量2 mol |
17.下列鉴别物质的方法不正确的是( )
| A. | 用燃烧的方法可以鉴别甲烷和乙烯 | |
| B. | 用酸性KMnO4溶液鉴别苯和CCl4 | |
| C. | 用银氨溶液鉴别蔗糖和葡萄糖 | |
| D. | 用KI溶液鉴别淀粉溶液和鸡蛋白溶液 |
18.设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 0.5 mol苯分子中含有C=C双键数目为1.5 NA | |
| B. | 常温常压下,17 g 羟基含有的电子总数为9NA | |
| C. | 标准状况下,11.2 L CHCl3 中含有的共价键数目为2NA | |
| D. | 将1 mol蔗糖与稀H2SO4混合使之完全水解,可生成2NA个葡萄糖分子 |