题目内容
1.92 g Cu投入到一定量的浓硝酸中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下672 ml气体,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的O2,恰好使气体完全溶于水,则通入O2的体积为
| A.504 ml | B.336 ml | C.224 ml | D.168 ml |
B
解析试题分析:1.92g Cu的物质的量为n(Cu)=1.92g÷64g/mol=0.03mol,反应时失去电子数目为2×0.03mol=0.06mol,反应整个过程为HNO3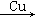 NO、NO2
NO、NO2 HNO3,反应前后HNO3的物质的量不变,而化合价变化的只有铜和氧气,则Cu失去电子数目等于O2得到电子的数目,所以消耗氧气的物质的量为n(O2)=0.06mol÷4=0.015mol,V(O2)=0.015mol×22400ml/mol=336ml,所以通入O2的体积为336ml,故答案选B。
HNO3,反应前后HNO3的物质的量不变,而化合价变化的只有铜和氧气,则Cu失去电子数目等于O2得到电子的数目,所以消耗氧气的物质的量为n(O2)=0.06mol÷4=0.015mol,V(O2)=0.015mol×22400ml/mol=336ml,所以通入O2的体积为336ml,故答案选B。
考点:考查氧化还原反应的有关计算

科技工作者提出用铝粉处理含亚硝酸盐废水的思路:调节亚硝酸盐废水酸碱性,使其pH>12,然后加入适量的铝粉、搅拌,从而实现预期且的。下列判断错误的是
| A.废水处理时铝单质转化为Al3+ | B.废水处理中,亚硝酸盐被还原 |
| C.处理过程中,OH一参与了反应 | D.铝粉颗粒大小影响废水处理的速率 |
已知某反应中反应物与生成物有:KIO3、Na2SO3、H2SO4、I2、K2SO4、H2O 和未知物X。下列说法中不正确的是
| A.该未知物X为Na2SO4 |
| B.该反应的氧化剂是KIO3 |
| C.该反应中,发生氧化反应的过程是KIO3→I2 |
| D.由反应可知还原性强弱顺序为:Na2SO3>I2 |
物质的量之比为1∶3的锌与稀硝酸混合,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,下列说法中正确的是( )
| A.在此反应中硝酸体现强氧化性,全部被还原 |
| B.向反应后的溶液中再加入金属铁,不再发生化学反应 |
| C.该反应中被还原的硝酸与未被还原的硝酸之比为1∶4 |
| D.该反应中被还原的硝酸与未被还原的硝酸之比为1∶5 |
为预防“H1N1”甲型流感,同学们每天用“84”消毒液(NaClO溶液)消毒,下列说法不正确的是( )
| A.NaClO溶液的消毒原理是使蛋白质变性 |
| B.1 mol Cl2与足量NaOH溶液反应转移2 mol电子 |
| C.NaClO溶液的漂白原理与Na2O2相同,与SO2不同 |
| D.“84”消毒液与“洁厕灵”(盐酸)混合使用可能会产生有毒的氯气 |
在碘酸钠(NaIO3)的碱性溶液中通入氯气,可以得到高碘酸钠(Na2H3IO6)。下列有关该反应的说法错误的是 ( )。
| A.在该反应中碘酸钠作还原剂 |
| B.碱性条件下,氯气的氧化性强于高碘酸钠的氧化性 |
| C.反应中生成1 mol Na2H3IO6转移2 mol电子 |
| D.反应中氧化产物与还原产物的物质的量之比为2∶1 |
在浓盐酸中H3AsO3与SnCl2反应的离子方程式为3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62—+6M。下列关于该反应的说法中,错误的是( )
| A.M为H2O |
| B.每还原1 mol氧化剂,就有3 mol电子转移 |
| C.还原性:SnCl2>As |
| D.氧化产物和还原产物的物质的量之比为2∶3 |
硫代硫酸钠(Na2S2O3)可作为脱氯剂,已知25 mL 0.1 mol/L Na2S2O3溶液恰好把224 mL(标准状况下)Cl2完全转化为Cl-,则S2O32-将转化为( )
| A.SO42- | B.SO32- | C.S | D.S2- |
在一种酸性溶液中,可能存在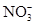 、I-、Cl-、Fe3+中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,则以下推测中不正确的是( )
、I-、Cl-、Fe3+中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,则以下推测中不正确的是( )
| A.一定有碘离子 | B.可能含铁离子 |
| C.可能有氯离子 | D.不含硝酸根离子 |