题目内容
已知某反应中反应物与生成物有:KIO3、Na2SO3、H2SO4、I2、K2SO4、H2O 和未知物X。下列说法中不正确的是
| A.该未知物X为Na2SO4 |
| B.该反应的氧化剂是KIO3 |
| C.该反应中,发生氧化反应的过程是KIO3→I2 |
| D.由反应可知还原性强弱顺序为:Na2SO3>I2 |
C
解析试题分析:Na2SO3是反应物,H2O是生成物,根据原子守恒,知硫酸是反应物,硫酸钠是生成物,根据化合价的变化判断亚硫酸钠是还原剂;另一种反应物是氧化剂,化合价的变化是由高变低,所以KIO3是氧化剂,还原产物是I2;2 KIO3 +5 Na2SO3 +H2SO4 ="5" Na2SO4 +I2+K2SO4+H2O ;根据化合价变化知,还原剂是Na2SO3,发生氧化反应,故C错误。
考点:考查。

 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案下图是一种综合处理SO2废气的工艺流程。下列说法正确的是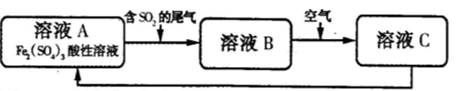
| A.向B溶液中滴加KSCN溶液,溶液变为血红色 |
| B.溶液B转化为溶液C发生的变化的离子方程式为4H++2Fe2++O2=2Fe3++2H2O |
| C.溶液酸性A>B>C |
| D.加氧化亚铁可以使溶液C转化为溶液A |
1.92 g Cu投入到一定量的浓硝酸中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下672 ml气体,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的O2,恰好使气体完全溶于水,则通入O2的体积为
| A.504 ml | B.336 ml | C.224 ml | D.168 ml |
三氟化氮(NF3)是微电子工业中一种优良的等离子蚀刻气体。它无色、无臭,在潮湿的空气中能发生下列反应:3NF3+5H2O 2NO+HNO3+9HF,下列有关说法正确的是( )
2NO+HNO3+9HF,下列有关说法正确的是( )
| A.反应中NF3是氧化剂,H2O是还原剂 |
| B.反应中被氧化与被还原的原子物质的量之比为2∶1 |
| C.若反应中生成0.2 mol HNO3,则反应共转移0.2 mol e- |
| D.NF3在潮湿的空气中泄漏会产生白雾、红棕色气体等现象 |
反应①、②分别是从海藻灰和某种矿石中提取碘的主要反应:
①2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2
下列说法正确的是( )
| A.两个反应中均为硫元素被氧化 |
| B.碘元素在反应①中被还原,在反应②中被氧化 |
| C.氧化性:MnO2>SO42—>IO3—>I2 |
| D.反应①、②中生成等量的I2时转移电子数比为1∶5 |
LiNiO2是锂离子电池的正极活性材料,其制备原理可表示为4Ni(OH)2+4LiOH+O2=4LiNiO2+6H2O。下列说法正确的是( )
| A.LiNiO2中Ni的化合价是+1 | B.该反应中LiOH是还原剂 |
| C.OH-和Li+含有的电子数相同 | D.LiNiO2中既含离子键又含共价键 |
将51.2 g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8 mol,这些气体恰好能被500 mL 2 mol/L NaOH溶液完全吸收,发生的反应为:
2NO2+2NaOH=NaNO2+NaNO3+H2O; NO+NO2+2NaOH=2NaNO2+H2O。
则生成的盐溶液中NaNO2的物质的量为( )
| A.0.4 mol | B.0.6 mol | C.0.8 mol | D.0.2 mol |
Na2FeO4是一种高效多功能水处理剂,一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2 +O2↑。下列对此反应的说法中,不正确的是( )
+O2↑。下列对此反应的说法中,不正确的是( )
| A.方框中的物质为Na2SO4 |
| B.Na2O2既是氧化剂,又是还原剂 |
| C.Na2FeO4既是氧化产物,又是还原产物 |
| D.2 mol FeSO4发生反应时,反应中共转移8 mol电子 |
氯酸是一种强酸,浓度超过40%时会发生分解,该反应可表示为aHClO3―→bO2↑+cCl2↑+dHClO4+eH2O,下列有关说法不正确的是 ( )。
| A.由反应可确定氧化性:HClO3>O2 |
| B.由非金属性:Cl>S,可推知酸性:HClO3>H2SO4 |
| C.若氯酸分解所得1 mol混合气体的质量为45 g,则反应的化学方程式可表示为3HClO3===2O2↑+Cl2↑+HClO4+H2O |
| D.若化学计量数a=8,b=3,则生成3 mol O2时该反应转移20 mol电子 |