题目内容
为预防“H1N1”甲型流感,同学们每天用“84”消毒液(NaClO溶液)消毒,下列说法不正确的是( )
| A.NaClO溶液的消毒原理是使蛋白质变性 |
| B.1 mol Cl2与足量NaOH溶液反应转移2 mol电子 |
| C.NaClO溶液的漂白原理与Na2O2相同,与SO2不同 |
| D.“84”消毒液与“洁厕灵”(盐酸)混合使用可能会产生有毒的氯气 |
B
解析

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案下列说法中正确的是( )
| A.含有金属元素的离子一定是阳离子,金属阳离子被还原一定得到金属单质 |
| B.pH相等的NaOH、NaHCO3和Na2CO3三种溶液: c(NaOH)<c(NaHCO3)<c(Na2CO3) |
| C.常温下,c(NH4+)相等的4种溶液:①(NH4)2SO4②(NH4)2Fe(SO4)2③NH4Cl ④(NH4)2CO3,溶质物质的量浓度大小关系是:②<①<④<③ |
| D.某温度时水的离子积常数KW=10-13若将此温度下pH=11的NaOH溶液aL与pH=1的稀硫酸bL混合,若所得混合液pH=2,则a:b=2:9 |
1.92 g Cu投入到一定量的浓硝酸中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下672 ml气体,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的O2,恰好使气体完全溶于水,则通入O2的体积为
| A.504 ml | B.336 ml | C.224 ml | D.168 ml |
将一定量的Fe和Fe2O3的混合物放入250 mL、1.8 mol·L-1的HNO3溶液中,当固体混合物完全溶解后,在标准状况下生成1.12 L NO(HNO3的还原产物仅此一种),再向反应后的溶液中加入1.0 mol·L-1 NaOH溶液,若要使铁元素完全沉淀,所加入的NaOH溶液的体积最少应为( )
| A.300 mL | B.400 mL | C.450 mL | D.500 mL |
工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对生态系统造成很大的损害,其中还原沉淀法是常用的一种处理方法。流程如下:
\其中第①步中存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O。下列有关说法正确的是( )
Cr2O72—(橙色)+H2O。下列有关说法正确的是( )
| A.第①步当2v(Cr2O72—)=v(CrO42—)时,达到了平衡状态 |
| B.对于上述平衡,加入适量稀硫酸后,溶液颜色变黄色,则有利于CrO42—的生成 |
| C.第②步中,还原0.1 mol Cr2O72—需要45.6 g FeSO4 |
| D.第③步沉淀剂a可以使用NaOH等碱性物质 |
三氟化氮(NF3)是微电子工业中一种优良的等离子蚀刻气体。它无色、无臭,在潮湿的空气中能发生下列反应:3NF3+5H2O 2NO+HNO3+9HF,下列有关说法正确的是( )
2NO+HNO3+9HF,下列有关说法正确的是( )
| A.反应中NF3是氧化剂,H2O是还原剂 |
| B.反应中被氧化与被还原的原子物质的量之比为2∶1 |
| C.若反应中生成0.2 mol HNO3,则反应共转移0.2 mol e- |
| D.NF3在潮湿的空气中泄漏会产生白雾、红棕色气体等现象 |
某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3—、N2、Cl-六种物质。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是( )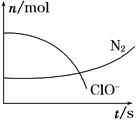
| A.还原剂是含CN-的物质,氧化产物只有N2 |
| B.氧化剂是ClO- , 还原产物是HCO3— |
| C.配平后氧化剂与还原剂的化学计量数之比为5∶2 |
| D.若生成2.24 L N2(标准状况),则转移电子0.5 mol |
LiNiO2是锂离子电池的正极活性材料,其制备原理可表示为4Ni(OH)2+4LiOH+O2=4LiNiO2+6H2O。下列说法正确的是( )
| A.LiNiO2中Ni的化合价是+1 | B.该反应中LiOH是还原剂 |
| C.OH-和Li+含有的电子数相同 | D.LiNiO2中既含离子键又含共价键 |
LiAlH4是金属储氢材料又是有机合成中的常用试剂,遇水能剧烈反应释放出氢气,LiAlH4在125 ℃分解为LiH、H2和Al。下列叙述错误的是( )。
| A.LiAlH4与乙醛作用生成乙醇,LiAlH4作还原剂 |
| B.LiAlH4与D2O反应,所得氢气的摩尔质量为4 g·mol-1 |
| C.1 mol LiAlH4在125 ℃完全分解,转移3 mol电子 |
| D.LiAlH4与水反应生成三种物质时,化学方程式可表示为:LiAlH4+4H2O=Al(OH)3+LiOH+4H2↑ |