题目内容
科技工作者提出用铝粉处理含亚硝酸盐废水的思路:调节亚硝酸盐废水酸碱性,使其pH>12,然后加入适量的铝粉、搅拌,从而实现预期且的。下列判断错误的是
| A.废水处理时铝单质转化为Al3+ | B.废水处理中,亚硝酸盐被还原 |
| C.处理过程中,OH一参与了反应 | D.铝粉颗粒大小影响废水处理的速率 |
A
解析试题分析:A、pH>12溶液显碱性,则废水处理时铝单质转化为AlO2-,A不正确;B、铝是金属,具有还原性,因此废水处理中,亚硝酸盐被还原,B正确;C、废水处理时铝单质转化为AlO2-,这说明处理过程中,OH一参与了反应,C正确;D、固体反应物的表面积越大反应速率越快,因此铝粉颗粒大小影响废水处理的速率,D正确,答案选A。
考点:考查铝、亚硝酸盐的性质、外界条件对反应速率的影响以及氧化还原反应的有关判断

练习册系列答案
相关题目
工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的危害,必须进行处理。下面是一种处理方法的工业流程: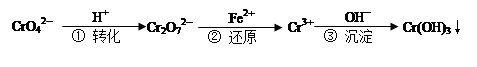
下列说法正确的是:
| A.改变反应①的平衡体系中c(H+)浓度,溶液颜色无明显变化 |
| B.若2v (Cr2O72—) ="v" (CrO42—),说明反应①达平衡状态 |
| C.反应②中还原1mol Cr2O72—,需要6 mol的Fe2+ |
D.FeSO4溶液呈酸性的原因是Fe2++ 2H2O  Fe(OH) 2↓+ 2H+ Fe(OH) 2↓+ 2H+ |
下列说法中正确的是( )
| A.含有金属元素的离子一定是阳离子,金属阳离子被还原一定得到金属单质 |
| B.pH相等的NaOH、NaHCO3和Na2CO3三种溶液: c(NaOH)<c(NaHCO3)<c(Na2CO3) |
| C.常温下,c(NH4+)相等的4种溶液:①(NH4)2SO4②(NH4)2Fe(SO4)2③NH4Cl ④(NH4)2CO3,溶质物质的量浓度大小关系是:②<①<④<③ |
| D.某温度时水的离子积常数KW=10-13若将此温度下pH=11的NaOH溶液aL与pH=1的稀硫酸bL混合,若所得混合液pH=2,则a:b=2:9 |
在一个氧化还原反应体系中反应物、生成物共六种粒子,Fe3+、NO3—、Fe2+、NH4+、H+、H2O,下列叙述正确的是
| A.该反应说明Fe(NO3)2溶液不宜加酸酸化 |
| B.该反应中氧化剂与还原剂物质的量之比为8:1 |
| C.若有1mol NO3—发生氧化反应,转移电子5mol |
| D.若将该反应设计成原电池,则负极反应为Fe3++e—=Fe2+ |
下图是一种综合处理SO2废气的工艺流程。下列说法正确的是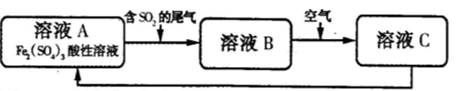
| A.向B溶液中滴加KSCN溶液,溶液变为血红色 |
| B.溶液B转化为溶液C发生的变化的离子方程式为4H++2Fe2++O2=2Fe3++2H2O |
| C.溶液酸性A>B>C |
| D.加氧化亚铁可以使溶液C转化为溶液A |
1.92 g Cu投入到一定量的浓硝酸中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下672 ml气体,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的O2,恰好使气体完全溶于水,则通入O2的体积为
| A.504 ml | B.336 ml | C.224 ml | D.168 ml |
根据表中信息,判断下列叙述中正确的是 ( )。
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | / | Fe3+、Br2 | |
| ② | KClO3 | 浓盐酸 | / | Cl2 | |
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
A.由表中①组的信息可知通入Cl2的量不同,氧化产物可能不同
B.氧化性强弱的比较:KClO3>Fe3+>Cl2>Br2
C.表中②组反应的还原产物是KCl,电子转移数目是6e-
D.表中③组反应的离子方程式为2MnO4—+3H2O2+6H+=2Mn2++4O2↑+6H2O
已知NH4CuSO3与足量的2 mol/L硫酸溶液混合微热,产生下列现象:①有红色金属生成 ②产生刺激性气味的气体 ③溶液呈现蓝色。据此判断下列说法正确的是( )
| A.反应中硫酸做氧化剂 |
| B.NH4CuSO3中硫元素被氧化 |
| C.1 mol NH4CuSO3完全反应转移0.5 mol电子 |
| D.刺激性气味的气体是氨气 |