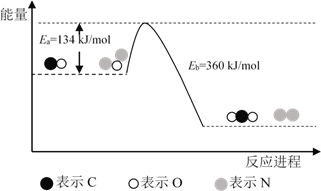
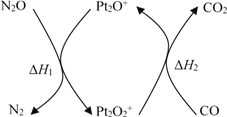
题目内容
【题目】向足量的硫酸溶液中加入200mL 0.4mol/L 的Ba(OH)2溶液,放出10.24kJ的热量。向足量的Ba(OH)2溶液中加入200mL 0.4mol/L 的HCl溶液,放出2.2kJ的热量。则硫酸钠溶液和氯化钡溶液反应的离子的热化学方程式为
A.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H = -2.92 kJ/mol
B.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H = -18 kJ/mol
C.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H = -0.72 kJ/mol
D.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H = -73 kJ/mol
【答案】D
【解析】
向足量的硫酸溶液中加入200mL 0.4mol/L 的Ba(OH)2溶液,生成0.08mol硫酸钡和0.16mol水,放出的热量是10.24 kJ;如果向足量Ba(OH)2溶液中加入200mL 0.4mol/L 的HCl溶液时,生成0.08mol水放出的热量为2.2 kJ。则只生成0.16mol水时放出的热量是4.4kJ,所以只生成0.08mol硫酸钡时放出的热量是10.24-4.4=5.84kJ,所以生成1mol硫酸钡时放出的热量是![]() =73kJ/mol,
=73kJ/mol,
答案选D。

练习册系列答案
相关题目