题目内容
【题目】以白云石(主要成分为MgCO3 ·CaCO3)为原料制取氢氧化镁的工艺流程如下:

(1)白云石属于_______物(选填“纯净”或“混合”),在轻烧过程中只发生碳酸镁的分解,则依图可判断“轻烧”温度不能超过______℃。“研磨”的目的是_________________。
(2)已知加热过程中硫酸铵与MgO反应生成一种盐、氨气和水。则加入氨水时的化学方程式为________________________。整个流程中能循环利用的是 _________________。
(3)传统工艺制备氢氧化镁是将白云石在高温下分解产生氧化镁和氧化钙再提取,而本工艺采取轻烧,其优点在于___________________、_____________________。
【答案】混合 700 增大反应物接触面积,加快反应速率 MgSO4+ 2NH3·H2O==Mg(OH)2↓+ (NH4)2SO4 (NH4)2SO4和NH3 减少能源消耗 便于碳酸钙分离
【解析】
(1)白云石属于混合物,碳酸镁分解生成氧化镁和二氧化碳;“研磨”的目的是增大反应物接触面积,加快反应速率;
(2)硫酸铵与氧化镁在加热条件下反应生成硫酸镁、氨气和水;根据流程图可以看出,氨气和硫酸铵能循环利用;
(3)采用轻烧白云石的方法制备氢氧化镁,能减少能源消耗、便于CaCO3分离。
(1)白云石属于混合物,碳酸镁分解生成氧化镁和二氧化碳,根据图2可以看出温度不能超过700℃;“研磨”的目的是增大反应物接触面积,加快反应速率;
(2)硫酸铵与氧化镁在加热条件下反应生成硫酸镁、氨气和水,则加入氨水时的化学方程式为MgSO4+ 2NH3·H2O=Mg(OH)2↓+ (NH4)2SO4;根据流程图可以看出,氨气和硫酸铵能循环利用,故整个流程中能循环利用的是(NH4)2SO4和NH3;
(3)采用轻烧白云石的方法制备氢氧化镁,能减少能源消耗、便于CaCO3分离。

 阅读快车系列答案
阅读快车系列答案【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液。然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。方案如下:
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度℃ | ||
浓度/(mol·L-1) | 体积/mL | 浓度/(mol·L-1) | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4溶液转化为MnSO4,该反应的离子方程式为______________________,每消耗1 mol H2C2O4转移_____mol电子。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4)≥________。
(2)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是____________。
(3)实验①测得KMnO4溶液的褪色时间为40 s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=________mol·L-1·s-1。
(4)已知50 ℃时c(MnO4-)~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25 ℃时c(MnO4-)~t的变化曲线示意图。_____________
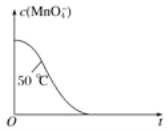
(5)有同学做实验时发现,酸性高锰酸钾溶液与草酸溶液反应开始时,溶液褪色慢,但过了一段时间后溶液褪色明显加快。针对上述实验现象,该同学提出以下的猜想。
猜想a:酸性高锰酸钾与草酸溶液的反应放热,导致溶液温度升高,反应速率加快。
猜想b:________________________________________。
若用实验证明你的猜想。除酸性高锰酸钾溶液,草酸溶液外,还需要选择的试剂最合理的是__________
A硫酸钾 B硫酸锰 C二氧化锰 D水