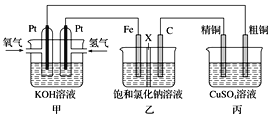
题目内容
【题目】下列解释事实的离子方程式不正确的是( )
A.铝片放入NaOH溶液中有气体产生:2Al+2OH﹣+2H2O=2AlO2+3H2↑
B.向K2Cr2O7溶液中滴加少量浓H2SO4,溶液橙色加深:Cr2O72(橙色)+H2O2CrO42(黄色)+2H+
C.向Na2SiO3溶液中通入过量CO2制备硅酸凝胶:SiO32- +CO2+H2O=H2SiO3(胶体)+ CO32-
D.用Na2CO3溶液浸泡锅炉水垢(含CaSO4):CaSO4+CO32-![]() CaCO3+SO42-
CaCO3+SO42-
【答案】C
【解析】
A.铝片放入NaOH溶液发生反应生成偏铝酸钠和氢气,离子反应为:2Al+2OH﹣+2H2O=2 AlO2+3H2↑,故A正确;
B.K2Cr2O7溶液中存在Cr2O72(橙色)+H2O2CrO42(黄色)+2H+,滴加少量浓H2SO4,增大氢离子浓度,平衡逆向移动,颜色加深,故B正确;
C.碳酸的酸性强于硅酸,向Na2SiO3溶液中通入过量CO2制备硅酸凝胶,符合强酸制取弱酸,二氧化碳过量时,生成碳酸氢根离子,离子反应方程式为:SiO32-+2CO2+2H2O=H2SiO3(胶体)+2HCO3-,故C错误;
D.碳酸钙溶解度小于硫酸钙,碳酸钠与硫酸钙反应生成碳酸钙和硫酸钠,离子方程式:CaSO4+CO32-![]() CaCO3+SO42-,故D正确;
CaCO3+SO42-,故D正确;
答案选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液。然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。方案如下:
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度℃ | ||
浓度/(mol·L-1) | 体积/mL | 浓度/(mol·L-1) | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4溶液转化为MnSO4,该反应的离子方程式为______________________,每消耗1 mol H2C2O4转移_____mol电子。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4)≥________。
(2)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是____________。
(3)实验①测得KMnO4溶液的褪色时间为40 s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=________mol·L-1·s-1。
(4)已知50 ℃时c(MnO4-)~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25 ℃时c(MnO4-)~t的变化曲线示意图。_____________
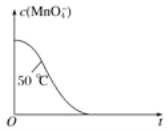
(5)有同学做实验时发现,酸性高锰酸钾溶液与草酸溶液反应开始时,溶液褪色慢,但过了一段时间后溶液褪色明显加快。针对上述实验现象,该同学提出以下的猜想。
猜想a:酸性高锰酸钾与草酸溶液的反应放热,导致溶液温度升高,反应速率加快。
猜想b:________________________________________。
若用实验证明你的猜想。除酸性高锰酸钾溶液,草酸溶液外,还需要选择的试剂最合理的是__________
A硫酸钾 B硫酸锰 C二氧化锰 D水