题目内容
【题目】有一处于平衡状态的反应:2X(s)+Y(g)![]() 2Z(g) △H小于0,为了使平衡向生成Z的方向移动,应选择的条件是( )
2Z(g) △H小于0,为了使平衡向生成Z的方向移动,应选择的条件是( )
①升高温度 ②降低温度 ③增大压强 ④降低压强 ⑤加入正催化剂 ⑥分离出Z
A.①③⑤B.②③⑤C.②③⑥D.②④⑥
【答案】D
【解析】
该反应为气体体积增大的放热反应,根据外因对化学平衡的影响效果分析作答。
①升高温度,平衡向吸热反应移动,即向逆反应方向(消耗Z的方向)移动;
②降低温度,平衡向放热反应移动,即向生成Z的方向移动;
③压强增大,平衡向气体体积减小的方向移动,即向消耗Z的方向移动;
④降低压强,平衡向气体体积增大的方向移动,即向生成Z的方向移动;
⑤加催化剂不会引起化学平衡的移动;
⑥分离出Z,等于减小生成物的浓度,平衡正向移动,即向生成Z的方向移动;
综上分析,②④⑥符合题意,D项正确;
答案选D。

【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液。然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。方案如下:
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度℃ | ||
浓度/(mol·L-1) | 体积/mL | 浓度/(mol·L-1) | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4溶液转化为MnSO4,该反应的离子方程式为______________________,每消耗1 mol H2C2O4转移_____mol电子。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4)≥________。
(2)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是____________。
(3)实验①测得KMnO4溶液的褪色时间为40 s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=________mol·L-1·s-1。
(4)已知50 ℃时c(MnO4-)~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25 ℃时c(MnO4-)~t的变化曲线示意图。_____________
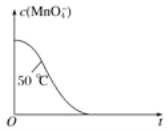
(5)有同学做实验时发现,酸性高锰酸钾溶液与草酸溶液反应开始时,溶液褪色慢,但过了一段时间后溶液褪色明显加快。针对上述实验现象,该同学提出以下的猜想。
猜想a:酸性高锰酸钾与草酸溶液的反应放热,导致溶液温度升高,反应速率加快。
猜想b:________________________________________。
若用实验证明你的猜想。除酸性高锰酸钾溶液,草酸溶液外,还需要选择的试剂最合理的是__________
A硫酸钾 B硫酸锰 C二氧化锰 D水