题目内容
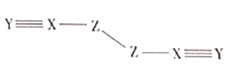
【题目】X、Y、Z、W是四种原子序数依次增大的短周期元素,W的最外层电子数比X的最外层电子数少1个,X、Y、Z为同一周期元素,X、Y、Z组成一种化合物![]() 的结构式如图所示。下列说法错误的是( )
的结构式如图所示。下列说法错误的是( )
A.Z与W形成的化合物熔点高
B.Y与Z能形成多种化合物
C.X的氢化物的沸点一定小于Z的氢化物
D.化合物![]() 中所有原子均满足8电子稳定结构
中所有原子均满足8电子稳定结构
【答案】C
【解析】
由(ZXY)2的结构可知,X能够形成四条共价键,Y能够形成三条共价键,Z能够形成两条共价键;此外,W的原子序数比X大,且W的最外层电子数比X的小1;因此推测X为C元素,那么Y为N元素,Z为O元素,W则为Al元素。
A.通过分析可知,Z与W形成的化合物即氧化铝,氧化铝熔点很高,可用作耐高温材料,A项正确;
B.通过分析可知,Y为N元素,Z为O元素;氮的氧化物有多种如NO,NO2,N2O4等,B项正确;
C.通过分析可知,Z为O元素,其氢化物为水或过氧化氢;X为C元素,烃类都可认为是其氢化物,有的沸点低有的沸点高;因此X的氢化物沸点不一定小于Z的氢化物,C项错误;
D.通过分析可知,(ZXY)2即(OCN)2,由其结构可知,分子中C、N。O都达到了8电子稳定结构,D项正确;
答案选C。

【题目】甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=________kJ.mol-1,已知△H2=-58kJ.mol-1,则△H3=_________kJ.mol-1
(2)反应①的化学平衡常数K的表达式为_____________;图1中能正确反映平衡常数K随温度变化关系的曲线为______(填曲线标记字母),其判断理由是__________________。
 .
.