题目内容
【题目】钴及其化合物有着广泛的应用前景。回答下列问题:
(1)基态Co原子的核外电子排布式为_________.
(2)以无水乙醇作溶剂,Co(NO3)2可与某多齿配体结合形成具有催化活性的配合物,其结构简式如图所示。
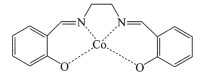
①配合物中提供孤对电子的原子是_________(填元素符号);
②该多齿配体中所含元素电负性由大到小的顺序为__________(填元素符号):
③下列化合物与上述配合物中C和N原子的杂化类型均相同的是__________(填标号)。
A.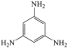 B.
B. C.
C. D.
D.
(3)亚硝酸钴钠可与K+结合形成K2Na[Co(NO2)6],从而实现对K+的定量测定。
①K2Na[Co(NO2)6]中存在的化学键类型有_________(填标号);
A.金属键 B.离子键 C.极性共价键 D.配位键
②与亚硝酸根互为等电子体的化合物有_________(写一种)。
(4)Co与Ca属于同一周期,且最外层电子数相同,但金属Co的熔点、沸点均比金属Ca的高,原因是____。
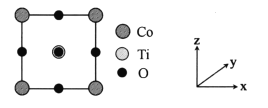
(5)某种铁酸钴(CoTiO3)晶胞沿x、y或z轴任意一个方向的投影如下图所示。晶胞中Co处于各顶角位置,则O处于_________位置,与Co紧邻的O的个数为_________。若晶胞中Co与O的距离为anm,阿伏加德罗常数的值为NA,该晶体的密度为_________g.cm-3(列出计算式)。
【答案】[Ar]3d74s2或1s22s22p63s23p63d74s2 O、N O>N>C>H B BCD SO2或SnO2 Co原子半径小且价电子数多,金属键强 面心 12 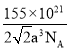 或
或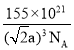 或
或![]() 或
或
【解析】
根据均摊法和化合物的分子式确定氧原子的位置和与Co紧邻的O的个数,利用晶胞的质量和体积计算晶胞密度。
(1)Co是27号元素,基态Co原子的核外电子排布式为[Ar]3d74s2或1s22s22p63s23p63d74s2;
(2)①根据配合物的结构和配位键的形成特点,配合物中提供孤对电子的原子是O、N;
②该多齿配体中所含元素为H、C、N、O,C、N、O位于同一周期,同周期元素从左到右电负性逐渐增强,故电负性由大到小的顺序为O>N>C,H元素与C、N、O形成化合物时,一般氢元素的化合价为正价,故电负性最小,故电负性的大小为O>N>C>H;
③上述配合物中C位于苯环上和亚甲基上,苯环上的碳原子价层电子对数为3对,采用的是sp2杂化,亚甲基上的碳原子价层电子对数为4对,亚甲基上的碳原子采用sp3杂化,N原子的价层电子对数为3对,杂化类型sp2杂化,
A. 中苯环上的碳原子碳原子价层电子对数为3对,采用的是sp2杂化,N原子的价层电子对数为3对,杂化类型sp2杂化,故A不符合题意;
中苯环上的碳原子碳原子价层电子对数为3对,采用的是sp2杂化,N原子的价层电子对数为3对,杂化类型sp2杂化,故A不符合题意;
B.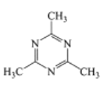 .中氮环上的碳原子碳原子价层电子对数为3对,采用的是sp2杂化,甲基上的碳原子价层电子对数为4对,亚甲基上的碳原子采用sp3杂化,N原子的价层电子对数为3对,杂化类型sp2杂化,故B符合题意;
.中氮环上的碳原子碳原子价层电子对数为3对,采用的是sp2杂化,甲基上的碳原子价层电子对数为4对,亚甲基上的碳原子采用sp3杂化,N原子的价层电子对数为3对,杂化类型sp2杂化,故B符合题意;
C.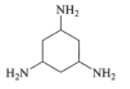 中环己烷上的碳原子价层电子对数诶4对,均采用sp3杂化,N原子的价层电子对数为3对,杂化类型sp2杂化,故C不符合题意;
中环己烷上的碳原子价层电子对数诶4对,均采用sp3杂化,N原子的价层电子对数为3对,杂化类型sp2杂化,故C不符合题意;
D.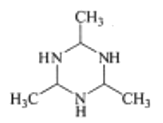 中碳原子价层电子对数为4对,均采用sp3杂化,N原子的价层电子对数为3对,杂化类型sp2杂化,故D不符合题意;
中碳原子价层电子对数为4对,均采用sp3杂化,N原子的价层电子对数为3对,杂化类型sp2杂化,故D不符合题意;
答案选B。
(3)根据图示,①K2Na[Co(NO2)6]中Co(NO2)6存在的化学键类型有极性共价键、配位键,亚硝酸钴钠可与K+形成离子键;
②与亚硝酸根互为等电子体的化合物有SO2或SnO2;
(4)Co与Ca属于同一周期,且最外层电子数相同,但金属Co的熔点、沸点均比金属Ca的高,原因是Co原子半径小且价电子数多,金属键强;
(5) 根据CoTiO3晶胞中Co处于各顶角位置,根据Co原子的数目为1个,O原子的数目为3个,则O处于面心位置,由图可知与Co紧邻的O的个数为12个,若晶胞中Co与O的距离为anm,则晶胞的边长为![]() cm,阿伏加德罗常数的值为NA,该晶体的密度为
cm,阿伏加德罗常数的值为NA,该晶体的密度为![]()
,化简可得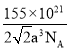 或
或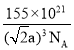 或
或![]() 。
。

【题目】马日夫盐![]() 用于钢铁制品,特别是大型机械设备的磷化处理,可起到防锈效果。以软锰矿(主要成分为
用于钢铁制品,特别是大型机械设备的磷化处理,可起到防锈效果。以软锰矿(主要成分为![]() 及少量的FeO、
及少量的FeO、![]() 和
和![]() )为原料制备马日夫盐的主要工艺流程如图:
)为原料制备马日夫盐的主要工艺流程如图:
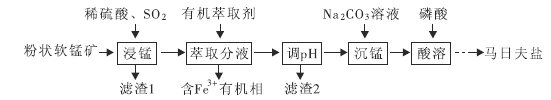
(1)“浸锰”过程中,FeO参与氧化还原反应的离子方程式为_______________。
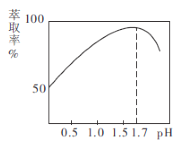
(2)![]() 的萃取率与溶液的pH的关系如图所示,当
的萃取率与溶液的pH的关系如图所示,当![]() 时,
时,![]() 的萃取率急剧下降的原因可能为_______________(用化学用语表示)。
的萃取率急剧下降的原因可能为_______________(用化学用语表示)。
(3)“调pH”的最大范围为________。
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
| l. 8 | 3.2 |
| 3.0 | 5.0 |
| 5.8 | 8.8 |
| 7.8 | 9.8 |
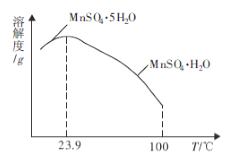
(4)如图为硫酸锰水合物的溶解度曲线,若要用“调pH”所得滤液制备![]() ,需要控制温度在80℃~90℃之间的原因是_____,采用水浴加热,经蒸发浓缩、_____(填操作名称)、用80℃~90℃的蒸馏水洗涤2~3次,放在真空干燥箱中低温干燥获得。
,需要控制温度在80℃~90℃之间的原因是_____,采用水浴加热,经蒸发浓缩、_____(填操作名称)、用80℃~90℃的蒸馏水洗涤2~3次,放在真空干燥箱中低温干燥获得。
(5)写出检验“沉锰”是否已完成的实验操作_________。
(6)常温下,马日夫盐溶液显________性(填“酸”或“碱”),理由是:____________。(写出计算过程并结合必要的文字说明。已知:![]() 的电离常数
的电离常数![]() ,
,![]() ,
,![]() )
)
【题目】甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=________kJ.mol-1,已知△H2=-58kJ.mol-1,则△H3=_________kJ.mol-1
(2)反应①的化学平衡常数K的表达式为_____________;图1中能正确反映平衡常数K随温度变化关系的曲线为______(填曲线标记字母),其判断理由是__________________。
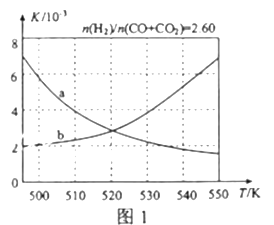 .
.