题目内容
《物质结构与性质》
A、B、C、D为原子序数依次增大的前四周期元素,元素A原子最外层电子数比内层多3个,元素B基态原子核外有2个未成对电子,元素C的最高价和最低价代数和等于0,元素D位于周期表ⅥB族。
⑴判断离子AB2-离子的空间构型为 。
⑵元素A、C形成的化合物熔点很高,但比B、C形成的化合物熔点低,其原因是 。
⑶在A的氢化物(A2H4)分子中,A原子轨道的杂化类型是 。
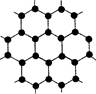
⑷元素B与D形成的一种化合物广泛应用于录音磁带上,其晶胞如图所示。该化合物的化学式为 。
⑸向D的氯化物DCl3溶液中滴加氨水可形成配合物[D(NH3)3(H2O)Cl2]Cl。
①离子D3+的外围电子排布式为 。
②1 mol该配合物中含配位键的数目为 。
⑴V形
⑵两种化合物均为原子晶体,Si—O键键能大于Si—N键
⑶sp3
⑷CrO2
⑸①3d3 ②6NA
(每空2分,共12分)
解析试题分析:A、B、C、D分别为N、O、Si、Cr。(1)NO2-中氮原子价电子对数为(5+1)÷2=3,为sp2杂化,空间结构为V形;(2)氮化硅和二氧化硅均为原子晶体,熔沸点高低与键能有关,半径小,键能大,熔沸点高;(3)化合物N2H4氮原子与氢原子形成单键,为sp3杂化;(4)晶胞中Cr为8×1/8+1=2,O为4×1/2+2=4,化学式为CrO2;(5)配合物中氨气、水、氯离子均与铬原子形成1个配位键,故1 mol该配合物中含配位键的数目为6NA。
考点:考查STS中环境保护有关问题。

 阅读快车系列答案
阅读快车系列答案现有部分元素的性质与原子(或分子)结构如下表:
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第3周期元素的简单离子中半径最小 |
(2)元素Y与元素Z相比,金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 (填序号)。
a.Y单质的熔点比Z单质低 b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈 d.Y最高价氧化物的水化物的碱性比Z强
e.Y失去电子的数目比Z少
(3)T、X、Y、Z中有两种元素能形成一种淡黄色的固体,写出该化合物的电子式 ,该物质中含有的化学键是 。
(4)元素T和氢元素以原子个数比1∶1化合形成化合物Q,元素X与氢元素形成的化合物W气态时密度等于氧气,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式 。
(5) X与Z形成的化合物ZX结构类似金刚石,最高可稳定到2200℃,推测属于
晶体。打开盛有ZX的袋口可闻到氨气味,故应避水保存,写出变质反应的化学方程式
。
(7分)决定物质性质的重要因素是物质结构。请回答下列问题:
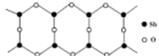
(1)铜是过渡元素。化合物中,铜常呈现+1价或+2价。右图为某铜氧化物晶体结构单元,该氧化物的化学式为 。
(2)第三周期部分元素氟化物的熔点见下表:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
(3)A和B为第三周期元素,其原子的部分电离能如下表所示:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
(4)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5、CrO2、Fe3O4中,更适合作录音带磁粉原料的是__________(填化学式)。
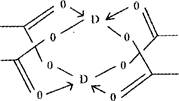
(5)实验室检验Ni2+可用丁二酮肟与之作用生成腥红色配合物沉淀。
②在配合物中用化学键和氢键标出未画出的作用力(镍的配位数为4)。
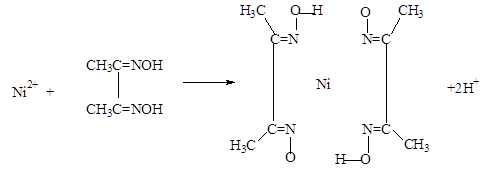
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:
(1)C、Si、N元素的电负性由大到小的顺序是 ,
C60和金刚石都是碳的同素异形体,二者相比,熔点高的是 ,原因是 。
(2)A、B均为短周期金属元素,依据表中数据,写出B的基态原子的电子排布式: 。
| 电离能/(kJ·mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
(4)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等。
①COCl2分子的结构式为
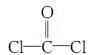 ,每个COCl2分子内含有 个σ键, 个π键,其中心原子采取 杂化轨道方式。
,每个COCl2分子内含有 个σ键, 个π键,其中心原子采取 杂化轨道方式。②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g)。反应过程中,断裂的化学键只有配位键,则形成的化学键类型是 。
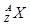 表示B原子的组成 ,
表示B原子的组成 ,