题目内容
(12分)【化学——物质结构与性质】
A、B、C、D、E是原子序数依次增大的五种元素。B元素原子最外层电子数比内层多3个,C、D元素同主族且原子序数D为C的二倍,E元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,回答下列问题。
(1)E元素基态原子的外围电子排布图为_______。
(2)元素B、C、D的第一电离能由小到大排列顺序为_______(用元素符号表示)。
(3) DC3冷凝可形成一种D、C相间的六元环结构的三聚体,其中D原子的杂化方式
为_______。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和1:2,
两种化合物可任意比互溶,其主要原因是________。
(5)A、B、C、D、E五种元素组成某配位化合物X,其原子个数比为18:6:4:1:1,
该配位化合物X的化学式为_________。
(6) Sb的一种氧化物高于843K时会转化为长链的大分子,
其结构片段如图,则该分子中Sb和O的原子个数比为_______ 。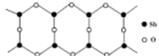
(12分)
(1)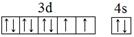 (2分)
(2分)
(2)S<O<N (2分)
(3)sp3 (2分)
(4)H2O与H2O2之间形成氢键(2分)
(5)[Ni(NH3)6]SO4(2分)
(6)2∶3(2分)
解析试题分析:B元素原子最外层电子数比内层多3个,则B为N元素;C、D元素同主族且原子序数D为C的二倍,则C为O元素、D为S元素;E元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则E为Ni元素。
(1)E为Ni元素,基态原子的外围电子排布图为: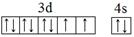
(2)元素B、C、D分别为N、O、S,N原子2p能级排布了3个电子,为半充满状态,较稳定,第一电离能大于O,所以第一电离能由小到大排列顺序为:S<O<N
(3)DC3冷凝可形成一种D、C相间的六元环结构的三聚体,则六元环上3个S和3个O依次交替,每个S再连接2个O,则每个S形成4个σ键,所以S原子的杂化方式为sp3
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和1:2,则A为H元素,两种化合物分别为H2O、H2O2,H2O与H2O2之间形成氢键,所以两种化合物可任意比互溶。
(5)A、B、C、D、E五种元素组成某配位化合物X,根据其原子个数比为18:6:4:1:1,可得化学式为:[Ni(NH3)6]SO4
(6)根据切割法,Sb位于公共边上,所以1个环含有Sb:4×1/2=2;位于上下顶点上的O只属于1个环,位于公共边上的O为2个环共用,所以1个环含有O:2×1/2+2=3,因此该分子中Sb和O的原子个数比为2:3。
考点:本题考查元素的推断、第一电离能、杂化方式、氢键、切割法的计算。

 快捷英语周周练系列答案
快捷英语周周练系列答案(本题共12分)
沸石是一大类天然结晶硅铝酸盐的统称。自然界中已发现的沸石有30多种,较常见的有方沸石NaAlSi2O6·H2O、钠沸石Na2Al2Si3O10·2H2O和钙沸石CaAl2Si3O10·3H2O等。
完成下列填空:
23.钠原子核外共有 种不同能量的电子,这些电子分占 种不同的轨道。
24.常温下,下列5种钠盐浓度均为0.1mol·L-1的溶液,对应的pH如下:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
25.NaOH在实验室中常用来进行洗气和提纯,当300mL 1mol·L-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为__________________________。
26.金属铝与一般的金属比较,在化学性质上表现出的三大特性为:
。
27.晶体硅、金刚石和金刚砂(SiC)硬度由大到小的顺序是 。
28.钙沸石CaAl2Si3O10·3H2O改写成氧化物的形式为 。
(8分)下图是元素周期表的一部分,其中每个数字编号代表对应的一种元素。
| ① | | | ||||||
| | | | | ② | ③ | ④ | | |
| ⑤ | | ⑥ | ⑦ | | | ⑧ | ⑨ | |
请按要求回答下列问题:
⑴ 画出元素②的原子结构示意图 。
⑵ 属于稀有气体的元素编号是_______,可作半导体材料的元素编号是______。
⑶③、⑦两种元素相比较,非金属性强的是 (填元素符号)。
⑷ 元素④的单质与元素⑤的单质反应可生成两种化合物,化学式分别是 , 。
⑸ 元素③和元素⑧的氢化物均极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,相互接近时,可看到大量的白烟,写出产生该现象的化学方程式: 。
(13分)(1)钠镁铝三种元素中第一电离能最大的是 。
(2)某正二价阳离子核外电子排布式为[Ar]3d54s0,该金属的元素符号为 。
(3)微粒间存在非极性键、配位键、氢键及范德华力的是 。
| A.NH4Cl晶体 | B.Na3AlF6晶体 | C.Na2CO3?10H2O晶体 |
| D.CuSO4溶液 E. CH3COOH溶液 |
| 键 | H-H | N-H | N-N | N=N | N≡N |
| 键能/kJ?mol-1 | 436 | 391 | 159 | 418 | 945 |
(5)乙醇和乙醚是同分异构体,但它们性质存在差异:
| | 分子式 | 结构简式 | 熔点 | 沸点 | 水溶性 |
| 乙醇 | C2H6O | C2H5OH | -114.3℃ | 78.4 °C | 互溶 |
| 二甲醚 | C2H6O | CH3OCH3 | -138.5℃ | -24.9℃ | 微溶 |
(6)金属铜溶于在浓氨水与双氧水的混合溶液,生成深蓝色溶液。该深蓝色的浓溶液中加入乙醇可见到深蓝色晶体析出,请画出呈深蓝色的离子的结构简式 。

 CO + H2S
CO + H2S