题目内容
根据元素周期表,填写下列空白:
(1)最活泼的非金属元素位于周期表中第 周期第 族、第 纵行。某元素B含有8个质子、10个中子,用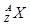 表示B原子的组成 ,
表示B原子的组成 ,
(2)在第三周期中,A、C两元素的原子序数之差为4,它们组成化合物AC的化学式为_____
(3)1mol某物质含有不同周期的三种元素各1mol,其核电荷总数为20mol,该物质的化学式为 ;它是 化合物(离子或共价)。
(1)二、ⅦA、17、 188O (2)MgS (3)NaOH 或 LiHS 离子
解析试题分析:(1)最活泼的非金属元素为氟元素,位于周期表中第二周期第ⅦA族、第17纵行。某元素B含有8个质子、10个中子,B原子的组成为188O;(2)在第三周期中,A、C两元素的原子序数之差为4,它们组成化合物AC的化学式为MgS ;(3)1mol某物质含有不同周期的三种元素各1mol,其核电荷总数为20mol,该物质的化学式为NaOH 或 LiHS;它是离子化合物。
考点:考查原子结构、元素周期表等知识。

价电子总数与原子总数都相同的分子、离子或原子团称为等电子体,等电子体具有相似的结构和性质。下列选项中互称为等电子体的是
A.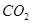 和 和 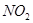 | B.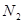 和 和  |
C.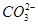 和 和 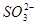 | D. 和 和 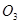 |
已知A、B、C、D、E、F、G位于元素周期表的前四周期,且元素原子序数依次增加,A焰色反应呈黄色;工业常用电解B的熔融的氯化物来制备B,C是一种能被HF和NaOH溶液溶解的单质,D的电负性比磷大,第一电离能却比磷小,E单质是制备漂白液的原料,F能形成红色(或砖红色)和黑色的两种氧化物,G是一种主族金属。
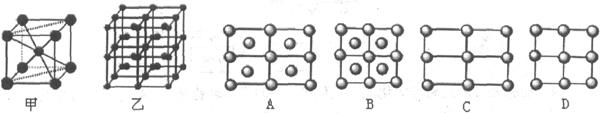
(1)前四周期所有元素中,基态原子中未成对电子与其所在周期数相同的元素有 种。
(2)元素A、B、C分别与氟气化合形成物质X、Y、Z熔点见下表:
| 氟化物 | X | Y | Z |
| 熔点/K | 1266 | 1534 | 183 |
(3)已知常温条件下,极性分子DOE2是一种液态化合物,中心原子D的杂化方式是 。向盛有10mL水的锥形瓶中滴加少量的DOE2溶液,生成两种有刺激性气味的气体。请书写此反应的化学方程式 。
(4)G与氮原子可1:1化合,形成人工合成的新型半导体材料,其晶体结构与单晶硅相似。G原子的价电子排布式为 。在该合成材料中,与同一个G原子相连的N原子构成的空间构型为正四面体。在四种基本晶体类型中,此晶体属于 晶体。
(5)F晶体的堆积方式是 (填堆积名称),其配位数为 。 向F的硫酸盐溶液中滴加氨水直至过量,写出此过程所涉及的两个离子方程式 根据价层电子对互斥理论,预测SO42-的空间构型为 。