题目内容
(11分)在第3周期中,置换酸中氢的能力最强的元素的元素符号为 ,化学性质最稳定的元素符号是 ,最高价氧化物的水化物的酸性最强的化合物的化学式是 ,最高价氧化物的水化物的碱性最强的化合物的化学式是 ,显两性的氢氧化物的化学式是 ,该两性氢氧化物与盐酸、氢氧钠溶液分别反应的离子方程式为 、 ,原子半径最大的金属元素的名称是 ,离子半径最小的离子结构示意图是 。
Na Ar HClO4 NaOH Al(OH)3 Al(OH)3 +3H+ =Al3+ +3H2O
Al(OH)3 +OH― = AlO2― +2H2O 钠 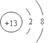
解析试题分析:元素的金属性越强,置换氢的能力就越强。在第三周期中,元素的金属性最强的元素是Na,所以Na置换酸中氢的能力最强;在同一周期中惰性气体的元素的化学性质最稳定。在第三周期中,化学性质最稳定的是Ar。元素的非金属性越强,去最高价氧化物的水化物的酸性最强,在第三周期的元素中,非金属性最强的元素是Cl,所以酸性最强的化合物的化学式是HClO4;在第三周期中 ,金属性周期是元素是Na,元素的金属性越强,其最高价氧化物对应的水化物的碱性就越强,所以最高价氧化物的水化物的碱性最强的化合物的化学式是NaOH;在第三周期中Al的氧化物、氢氧化物都显两性,所以显两性的氢氧化物的化学式是Al(OH)3;该物质与盐酸、氢氧钠溶液分别反应的离子方程式为Al(OH)3 +3H+ =Al3+ +3H2O;Al(OH)3 +OH― = AlO2― +2H2O;在同一周期的元素,原子序数越大,原子半径就越小,所以第三周期的元素中,原子半径最大的金属元素是钠;同一周期的金属元素的原子失去电子,形成上一周期的惰性气体元素的两种结构;非金属元素形成的是同一周期的大小气体元素的大小气体的原子结构。对于电子层结构相同的两种来说,核电荷数越大,两种半径越小;对于电子层结构不同的微粒来说,离子的电子层数越多,离子半径就越大。因此在第三周期中离子半径最小的离子是Al3+;其结构示意图是 。
。
考点:考查同一周期的元素的原子结构、性质的递变规律、离子方程式、原子结构示意图的表示的知识。

已知A、B、C、D、E、F、G位于元素周期表的前四周期,且元素原子序数依次增加,A焰色反应呈黄色;工业常用电解B的熔融的氯化物来制备B,C是一种能被HF和NaOH溶液溶解的单质,D的电负性比磷大,第一电离能却比磷小,E单质是制备漂白液的原料,F能形成红色(或砖红色)和黑色的两种氧化物,G是一种主族金属。
(1)前四周期所有元素中,基态原子中未成对电子与其所在周期数相同的元素有 种。
(2)元素A、B、C分别与氟气化合形成物质X、Y、Z熔点见下表:
| 氟化物 | X | Y | Z |
| 熔点/K | 1266 | 1534 | 183 |
(3)已知常温条件下,极性分子DOE2是一种液态化合物,中心原子D的杂化方式是 。向盛有10mL水的锥形瓶中滴加少量的DOE2溶液,生成两种有刺激性气味的气体。请书写此反应的化学方程式 。
(4)G与氮原子可1:1化合,形成人工合成的新型半导体材料,其晶体结构与单晶硅相似。G原子的价电子排布式为 。在该合成材料中,与同一个G原子相连的N原子构成的空间构型为正四面体。在四种基本晶体类型中,此晶体属于 晶体。
(5)F晶体的堆积方式是 (填堆积名称),其配位数为 。 向F的硫酸盐溶液中滴加氨水直至过量,写出此过程所涉及的两个离子方程式 根据价层电子对互斥理论,预测SO42-的空间构型为 。
(8分)下图是元素周期表的一部分,其中每个数字编号代表对应的一种元素。
| ① | | | ||||||
| | | | | ② | ③ | ④ | | |
| ⑤ | | ⑥ | ⑦ | | | ⑧ | ⑨ | |
请按要求回答下列问题:
⑴ 画出元素②的原子结构示意图 。
⑵ 属于稀有气体的元素编号是_______,可作半导体材料的元素编号是______。
⑶③、⑦两种元素相比较,非金属性强的是 (填元素符号)。
⑷ 元素④的单质与元素⑤的单质反应可生成两种化合物,化学式分别是 , 。
⑸ 元素③和元素⑧的氢化物均极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,相互接近时,可看到大量的白烟,写出产生该现象的化学方程式: 。
(13分)(1)钠镁铝三种元素中第一电离能最大的是 。
(2)某正二价阳离子核外电子排布式为[Ar]3d54s0,该金属的元素符号为 。
(3)微粒间存在非极性键、配位键、氢键及范德华力的是 。
| A.NH4Cl晶体 | B.Na3AlF6晶体 | C.Na2CO3?10H2O晶体 |
| D.CuSO4溶液 E. CH3COOH溶液 |
| 键 | H-H | N-H | N-N | N=N | N≡N |
| 键能/kJ?mol-1 | 436 | 391 | 159 | 418 | 945 |
(5)乙醇和乙醚是同分异构体,但它们性质存在差异:
| | 分子式 | 结构简式 | 熔点 | 沸点 | 水溶性 |
| 乙醇 | C2H6O | C2H5OH | -114.3℃ | 78.4 °C | 互溶 |
| 二甲醚 | C2H6O | CH3OCH3 | -138.5℃ | -24.9℃ | 微溶 |
(6)金属铜溶于在浓氨水与双氧水的混合溶液,生成深蓝色溶液。该深蓝色的浓溶液中加入乙醇可见到深蓝色晶体析出,请画出呈深蓝色的离子的结构简式 。

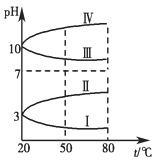
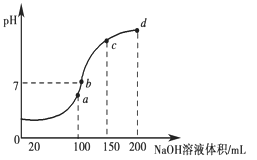
 , 试回答:
, 试回答: