题目内容
1.几种短周期元素的原子半径及主要化合价见表:| 元素符号 | X | Y | Z | R | T |
| 原子半径(nm) | 0.160 | 0.080 | 0.102 | 0.143 | 0.074 |
| 主要化合价 | +2 | +2 | -2,+4,+6 | +3 | -2 |
| A. | 单质与稀硫酸反应的速率快慢:R>Y>X | |
| B. | 离子半径:T2->X2+ | |
| C. | 元素最高价氧化物的水化物的碱性:Y>R>X | |
| D. | 气态氢化物的稳定性:Z>T |
分析 短周期元素,X、Y都有+2价,处于ⅡA族,原子半径X>Y,则X为Mg、Y为Be;Z、T都有-2价,而Z有+2、+6价,可推知Z为S元素、T为O元素;R有+3价,处于ⅢA族,原子半径大于S,则R为Al,据此结合元素周期律解答.
解答 解:短周期元素,X、Y都有+2价,处于ⅡA族,原子半径X>Y,则X为Mg、Y为Be;Z、T都有-2价,而Z有+2、+6价,可推知Z为S元素、T为O元素;R有+3价,处于ⅢA族,原子半径大于S,则R为Al,
A.金属性Mg>Al>Be,故与稀硫酸反应的速率快慢:Mg>Al>Be,故A正确;
B.电子层结构相同,核电荷数越大离子半径越小,故离子半径O2->Mg2+,故B正确;
C.金属性Mg>Al,故碱性Mg(OH)2>Al(OH)3,故C错误;
D.非金属性越强,气态氢化物越稳定,非金属性:O>S,故气态氢化物的稳定性:Z<T,故D错误;
故选AB.
点评 本题考查元素位置结构和性质的关系及应用,侧重对元素周期律的考查,题目难度中等,根据原子半径和元素化合价推断元素是解题关键,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.常温下,下列各组离子在指定溶液中一定能大量共存或离子方程式正确的是( )
| A. | 0.1mol•L-1Fe(NO3)2溶液:Mg2+、H+、SO${\;}_{4}^{2-}$、Cl- | |
| B. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、AlO${\;}_{2}^{-}$、CO${\;}_{3}^{2-}$、Na+ | |
| C. | Na2O2溶于水产生O2:2O22-+2H2O═O2↑+4OH- | |
| D. | 用过氧化氢从酸化海带灰浸出液中提取碘:2I-+H2O2═I2+2OH- |
18.NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,11.2 L的戊烷所含的分子0.5NA | |
| B. | 28 g乙烯所含共用电子对数目为4NA | |
| C. | 标准状况下,11.2 L二氯甲烷所含分子数为0.5 NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14 g,其原子数为3 NA |
10.下列表示物质结构的化学用语或模型正确的是( )
| A. | 醛基的电子式 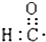 | B. | 丙烷的分子结构的比例模型: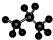 | ||
| C. | 乙烯的最简式(实验式):CH2 | D. | 硝基苯的结构简式: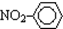 |
11.有人将甲醇设计成为一种燃料电池,并用硫酸作电解质,其中发生的化学反应为:甲醇与氧气反应生成水和二氧化碳(aq表示溶液).该电池负极发生的反应是( )
| A. | CH3OH(g)+O2(g)-2e-=H2O(1)+CO2(g)+2H+(aq) | B. | O2(g)+4H+(aq)+4e-=2H2O(1) | ||
| C. | CH3OH(g)+H2O(1)-6e-=CO2(g)+6H+(aq) | D. | CH3OH(g)+8OH--6e-=CO32-( aq)+6H2O |
 NH4+
NH4+
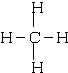 ; CO2O=C=O
; CO2O=C=O I.
I.

 .
.
