题目内容
11.下列说法中错误的是( )| A. | Al2(SO4)3可除去酸性废水中的悬浮颗粒 | |
| B. | 医药中常用酒精来消毒,是因为酒精能够使细菌蛋白发生变性 | |
| C. | 煤通过气化、液化和干馏等可获得清洁能源和重要的化工原料 | |
| D. | 高锰酸钾溶液和双氧水进行环境消毒时原理相同 |
分析 A.酸性溶液抑制铝离子的水解;
B.酒精可使蛋白质变性,常用于杀菌消毒;
C.煤通过气化、液化和干馏等可获得水煤气、甲醇以及苯等有机物;
D.高锰酸钾和双氧水都具有强氧化性.
解答 解:A.硫酸铝水解呈酸性,酸性溶液抑制铝离子的水解,不能起到除杂的作用,故A错误;
B.酒精可使蛋白质变性,医药中常用于75%的酒精来杀菌消毒,故B正确;
C.煤的气化是煤在氧气不足的条件下进行部分氧化形成H2、CO等气体的过程;煤的液化是将煤与H2在催化剂作用下转化为液体燃料或者利用煤产生的H2和CO通过化学合成产生液体燃料或者其他液体化工产品的过程;煤的干馏是指隔绝空气加强热,使煤分解的过程,可以得到很多重要的化工原料,故C正确;
D.高锰酸钾和双氧水都具有强氧化性,可使蛋白质变性,用于杀菌消毒,故D正确.
故选A.
点评 本题考查较为综合,多角度考查元素化合物知识,侧重于化学与生活、生产的考查,有利于培养学生的良好的科学素养,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.废弃物的综合利用既有利于节约资源,又有利于保护环境.实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)回收 Cu并制备ZnO的部分实验过程如下:
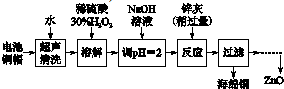
(1)①铜帽溶解时加入H2O2的目的是Cu+H2O2+H2SO4=CuSO4+2H2O (用化学方程式表示).
②铜帽溶解完全后,需将溶液中过量的H2O2除去.除去H2O2的简便方法是加热至沸.
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量.实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点.上述过程中反应的离子方程式如下:
2Cu2++4I-═2CuI(白色)↓+I2 2S2O+I2═2I-+S4O62-
①滴定选用的指示剂为淀粉溶液,滴定终点观察到的现象蓝色褪去且30秒不恢复蓝色.
②若滴定前溶液中的H2O2没有除尽,所测定的Cu2+含量将会偏高(填“偏高”、“偏低”或“不变”).
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
实验中可选用的试剂:30% H2O2、1.0mol•L-1 HNO3、1.0mol•L-1 NaOH.
由除去铜的滤液制备ZnO的正确实验步骤依次为:⑤④①②③⑥
①过滤;
②调节溶液pH约为10(或8.9≤pH≤11),使Zn2+沉淀完全;
③过滤、洗涤、干燥;
④调节溶液pH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全;
⑤向滤液中加入适量30% H2O2,使其充分反应;
⑥900℃煅烧;
(4)Zn(OH)2的溶度积常数为1.2×10-17(mol•L-1)3,当Zn2+沉淀完全时,此时溶液中Zn2+的浓度为1.2×10-7 mol•L-1.

(1)①铜帽溶解时加入H2O2的目的是Cu+H2O2+H2SO4=CuSO4+2H2O (用化学方程式表示).
②铜帽溶解完全后,需将溶液中过量的H2O2除去.除去H2O2的简便方法是加热至沸.
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量.实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点.上述过程中反应的离子方程式如下:
2Cu2++4I-═2CuI(白色)↓+I2 2S2O+I2═2I-+S4O62-
①滴定选用的指示剂为淀粉溶液,滴定终点观察到的现象蓝色褪去且30秒不恢复蓝色.
②若滴定前溶液中的H2O2没有除尽,所测定的Cu2+含量将会偏高(填“偏高”、“偏低”或“不变”).
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 9 |
由除去铜的滤液制备ZnO的正确实验步骤依次为:⑤④①②③⑥
①过滤;
②调节溶液pH约为10(或8.9≤pH≤11),使Zn2+沉淀完全;
③过滤、洗涤、干燥;
④调节溶液pH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全;
⑤向滤液中加入适量30% H2O2,使其充分反应;
⑥900℃煅烧;
(4)Zn(OH)2的溶度积常数为1.2×10-17(mol•L-1)3,当Zn2+沉淀完全时,此时溶液中Zn2+的浓度为1.2×10-7 mol•L-1.
16.水资源的利用、开发、保护直接关系到人类的生存和国民经济的发展.
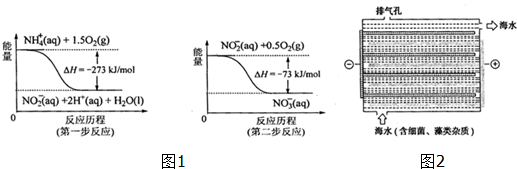
Ⅰ.饮用水中含所有一定浓度的NO3+将对人体健康产生危害,NO3+能氧化人体血红蛋白中的Fe(H),使其失去携氧功能.
(1)饮用水中的NO3+主要来自NO4+.已知在微生物作用下,NO4+经过两步反应被氧化成NO3+.两步反应的能量变化示意图如图1,试写出1molNO4+(ap)全部氧化成NO3+(ap)的热化学方程式NH4+(aq)+2O2(g)=2H+(aq)+NO3-(aq)+H2O(l)△H=-346kJ•mol-1.
(2)用H2催化还原法也可见底饮用水中NO3+的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为5H2+2NO3-$\frac{\underline{\;催化剂\;}}{\;}$N2+4H2O+2OH-.
(3)现测得某地水质试样中所含水溶性无机离子的化学组及其平均浓度如下表:根据表中数据计算该试样的pH=4
Ⅱ.海水淡化具有广泛的应用前景,淡化前需对海水进行预处理.
(1)通常用明矾[K2SO4•Al2(SO4)3•24H2O]作混凝剂,降低浊度.明矾水解的离子方程式是Al3++3H2O?Al(OH)3(胶体)+3H+.
(2)对海水进行消毒和灭藻处理时常用如图2所示NaClO的发生装置.
①装置中由NaCl转化为NaClO的化学方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑、2NaOH+Cl2=NaClO+NaCl+H2O.
②海水中含有Ca2+、Mg2+、HCO3-等杂质离子,处理过程中装置的阴极易产生水垢,其主要成分是Mg(OH)2和CaCO3.生成CaCO3的离子方程式是Ca2++HCO3-+OH-=CaCO3↓+H2O.
③若每隔5-10min倒换一次电极电性,可有效地解决阴极的结垢问题.试用电极反应式并结合必要的文字进行解释阴极结垢后倒换电极电性,阴极变为阳极,其电极反应为:2Cl--2e-=Cl2↑,产生的氯气与水发生反应:Cl2+H2O=HCl+HClO,使该电极附近溶液呈酸性,从而将Mg(OH)2和CaCO3溶解而达到除垢的目的.

Ⅰ.饮用水中含所有一定浓度的NO3+将对人体健康产生危害,NO3+能氧化人体血红蛋白中的Fe(H),使其失去携氧功能.
(1)饮用水中的NO3+主要来自NO4+.已知在微生物作用下,NO4+经过两步反应被氧化成NO3+.两步反应的能量变化示意图如图1,试写出1molNO4+(ap)全部氧化成NO3+(ap)的热化学方程式NH4+(aq)+2O2(g)=2H+(aq)+NO3-(aq)+H2O(l)△H=-346kJ•mol-1.
(2)用H2催化还原法也可见底饮用水中NO3+的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为5H2+2NO3-$\frac{\underline{\;催化剂\;}}{\;}$N2+4H2O+2OH-.
(3)现测得某地水质试样中所含水溶性无机离子的化学组及其平均浓度如下表:根据表中数据计算该试样的pH=4
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度(mol/L) | 3×10-6 | 7×10-6 | 2×10-5 | 3×10-5 | 5×10-5 | 2×10-5 |
(1)通常用明矾[K2SO4•Al2(SO4)3•24H2O]作混凝剂,降低浊度.明矾水解的离子方程式是Al3++3H2O?Al(OH)3(胶体)+3H+.
(2)对海水进行消毒和灭藻处理时常用如图2所示NaClO的发生装置.
①装置中由NaCl转化为NaClO的化学方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑、2NaOH+Cl2=NaClO+NaCl+H2O.
②海水中含有Ca2+、Mg2+、HCO3-等杂质离子,处理过程中装置的阴极易产生水垢,其主要成分是Mg(OH)2和CaCO3.生成CaCO3的离子方程式是Ca2++HCO3-+OH-=CaCO3↓+H2O.
③若每隔5-10min倒换一次电极电性,可有效地解决阴极的结垢问题.试用电极反应式并结合必要的文字进行解释阴极结垢后倒换电极电性,阴极变为阳极,其电极反应为:2Cl--2e-=Cl2↑,产生的氯气与水发生反应:Cl2+H2O=HCl+HClO,使该电极附近溶液呈酸性,从而将Mg(OH)2和CaCO3溶解而达到除垢的目的.
20.下列物质间的反应,其能量变化符合下图的是( )
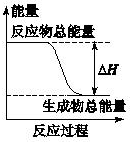

| A. | 由Zn和稀H2SO4反应制取氢气 | B. | 灼热的碳与二氧化碳反应 | ||
| C. | Ba(OH)2•8H2O晶体和NH4Cl晶体混合 | D. | 碳酸钙的分解 |
16.如图所示的电化学装置,电解质溶液为Na2SO4,下列说法不正确的是( )


| A. | 当闭合开关S1,断开开关S2,右石墨棒发生的电极反应为:2H2O-4e-=4H++O2↑ | |
| B. | 石墨棒使用前在高温火焰上灼烧至红热,迅速浸入冷水,可以使表面粗糙多空,吸附更多的气体 | |
| C. | 先闭合开关S1,一段时间后断开,再闭合S2,可以观察到发光二级管发光 | |
| D. | 断开S2,闭合S1,更换电解质,可以用来模拟工业制氯气,粗铜冶炼制精铜 |
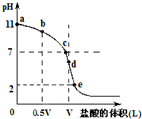 常温时向浓度为0.1mol/L体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图象回答下列问题:
常温时向浓度为0.1mol/L体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图象回答下列问题: