题目内容
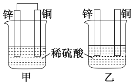
【题目】(1)理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Fe3+=Cu2++2Fe2+”设计一个原电池(正极材料用碳棒),回答下列问题:
该电池的负极材料是___,发生___反应(填“氧化”或“还原”);电解质溶液是___;若导线上转移电子1mol,则被氧化的物质___克。
(2)已知拆开1molH—H键、1molN≡N分别需要吸收的能量为akJ、bkJ,形成1molN—H键需要释放ckJ能量。且已知N2和H2合成NH3的反应是放热反应,则生成1molNH3需要放出___的热量。
(3)铜与一定量浓硝酸恰好完全反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,若向所得硝酸铜溶液中加入6mol·L-1NaOH溶液至Cu2+恰好完全沉淀,消耗NaOH溶液的体积是___mL。
【答案】Cu 氧化 FeCl3溶液 32 (3c-1.5a-0.5b)kJ 50
【解析】
(1)根据总反应式Cu+2Fe3+=Cu2++2Fe2+,Cu发生氧化反应,所以Cu作负极,负极反应为Cu-2e-=Cu2+,用碳棒作正极,FeCl3溶液作电解质溶液,Fe3+在正极得到电子,正极反应为Fe3++e-=Fe2+,据此分析解答;
(2)根据物质结构计算断键吸收和成键释放的能量,进而计算反应热;
(3)向所得硝酸铜溶液中加入NaOH溶液至Cu2+恰好完全沉淀,沉淀为Cu(OH)2,由电荷守恒可知,Cu提供电子物质的量等于氢氧化铜中氢氧根的物质的量,生成NO2、NO的混合气体与1.68L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,纵观整个过程,由电子转移守恒,可知Cu提供电子等于氧气获得的电子,据此计算n(NaOH),进而计算消耗氢氧化钠溶液体积。
(1)根据上述分析可知,Cu作负极,发生氧化反应,电解质溶液为FeCl3溶液,若导线上转移1mol电子,根据负极反应Cu-2e-=Cu2+可知,负极0.5molCu被氧化,被氧化的Cu的质量=0.5mol×64g/mol=32g,故答案为:Cu;氧化;FeCl3;32;
(2)根据化学方程式N2+3H2![]() 2NH3,生成1mol的NH3时需要消耗0.5mol的N2和1.5mol的H2,因此在上述的反应过程中断裂0.5mollN≡N键和1.5molH—H键,共吸收热量为0.5bkJ+1.5akJ=(0.5b+1.5a)kJ,形成1molNH3中的3molN—H键,共放出热量3ckJ,已知该反应为放热反应,则反应共放出3c-(0.5b+1.5a)=(3c-1.5a-0.5b)kJ的热量,故答案为:(3c-1.5a-0.5b)kJ;
2NH3,生成1mol的NH3时需要消耗0.5mol的N2和1.5mol的H2,因此在上述的反应过程中断裂0.5mollN≡N键和1.5molH—H键,共吸收热量为0.5bkJ+1.5akJ=(0.5b+1.5a)kJ,形成1molNH3中的3molN—H键,共放出热量3ckJ,已知该反应为放热反应,则反应共放出3c-(0.5b+1.5a)=(3c-1.5a-0.5b)kJ的热量,故答案为:(3c-1.5a-0.5b)kJ;
(3)NO2、N2O4、NO混合气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,说明整个过程中被还原的HNO3反应前后没有变化,即Cu失去的电子都被O2得到了,根据得失电子守恒建立关系式:n(Cu)×2=n(O2)×4,解得n(Cu)=0.075mol×2=0.15mol,根据Cu原子个数守恒可知Cu(NO3)2为0.15mol;根据 Cu2+—2OH-得NaOH为0.15mol×2=0.3mol,则NaOH溶液的体积V为0.3mol/6mol·L-1=50mL,故答案为:50。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】下列生产或实验事实引出的结论不正确的是( )
选项 | 事实 | 结论 |
A | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间缩短 | 当其他条件不变时,升高反应 温度,化学反应速率加快 |
B | 工业制硫酸过程中,在SO3的吸收阶段,吸收塔里要装填瓷环 | 增大气液接触面积,使SO3的吸收速率增大 |
C | 在容积可变的密闭容器中发生反应:2NH3(g) | 反应速率减慢 |
D | A.B两支试管中分别加入等体积5%的H2O2溶液,在B试管中加入2~3滴FeCl3溶液,B试管中产生气泡快 | 当其他条件不变时,催化剂可 以改变化学反应速率 |
A.AB.BC.CD.D
【题目】下列“实际应用”对应“化学知识原理”说法错误的是( )
选项 | 实际应用 | 化学知识原理 |
A | 泡沫灭火器中装有碳酸氢钠溶液 和硫酸铝溶液 | 碳酸氢钠溶液和硫酸铝溶液水解且相互促进 |
B | 工业上采用高压(20-50MPa)合成NH3 | 应用勒夏特列原理 |
C | 施加石膏降低盐碱地(含Na2CO3)的碱性 | CaCO3溶度积小于CaSO4 |
D | 选用金属锂做电池电极材料 | 锂轻且在空气中稳定 |
A. AB. BC. CD. D