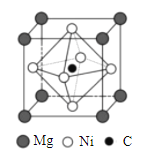
题目内容
【题目】Na2O2、CaC2都是离子化合物,都能与水反应放出气体。(Na2O2+2H2O=4NaOH+O2)它们( )
A.阴阳离子个数比均为![]() B.都含有非极性的共价键
B.都含有非极性的共价键
C.与水都发生氧化还原反应D.放出的都是可燃性气体
【答案】B
【解析】
A.过氧化钠中阴阳离子个数比为1∶2,碳化钙中阴阳离子个数比为1∶1,故A错误;
B.非金属元素之间易形成共价键,其中过氧化钠中存在O-O非极性键,CaC2中存在C≡C非极性键,所以两种物质中都含有非极性键,故B正确;
C.碳化钙和水反应生成氢氧化钙和乙炔,各元素的化合价都不变,不属于氧化还原反应,故C错误;
D.过氧化钠和水反应生成氧气,氧气能助燃,不属于可燃性气体,碳化钙和水反应生成乙炔,乙炔易燃烧,故D错误;
故选B。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
【题目】如图是物质间发生化学反应的颜色变化,其中物质a、b、c、d对应的物质正确的是( )
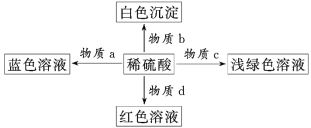
选项 | 物质a | 物质b | 物质c | 物质d |
A | Cu2(OH)2CO3 | Ba(OH)2 | Fe(OH)3 | 酚酞溶液 |
B | CuO | NaAlO2 | Fe2O3 | 紫色石蕊溶液 |
C | CuO | BaCl2 | FeO | 酚酞溶液 |
D | Cu(OH)2 | Ba(NO3)2 | FeO | 紫色石蕊溶液 |
A. AB. BC. CD. D