题目内容
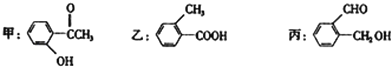
【题目】A、B、C、D、E、F是核电荷数依次增大的六种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。(请用化学用语回答下列问题)
(1)B在周期表中的位置_______________
(2)F元素的最高价氧化物对应的水化物的化学式为_____。
(3)用电子式表示化合物D2C的形成过程____________。C、D还可形成化合物D2C2,其电子式为____________。
(4)C、E的氢化物,沸点由高到低顺序是:__________其原因是_____________。
(5)写出碳单质与B的最高价氧化物对应水化物浓溶液反应的化学方程式,并用单线桥标明电子的转移方向_________。当转移电子为0.2mol时,标准状况下反应产生气体_______L
(6)已知E单质和F单质的水溶液反应会生成两种强酸,其化学反应方程式为:________。
【答案】第二周期第VA族 HClO4 ![]()
![]() H2O>H2S 水分子之间存在氢键
H2O>H2S 水分子之间存在氢键 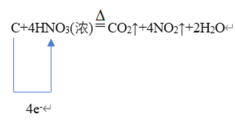 5.6 S+ 3Cl2 +4H2O=H2SO4 + 6HCl
5.6 S+ 3Cl2 +4H2O=H2SO4 + 6HCl
【解析】
根据题目已知信息分析,A中只有1个质子,则A为H元素;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3,说明B是第二周期元素,B为N元素;C元素原子的最外层电子数比次外层多4,则C为O元素;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C,D为Na元素;C、E同主族,则E为S元素;F为Cl元素,据此分析。
(1)根据分析,B为N元素,为第二周期第VA族元素;
(2)F元素为Cl元素,其的最高价氧化物对应的水化物的化学式为HClO4;
(3)Na2O的形成过程为![]() ,Na2O2的电子式为
,Na2O2的电子式为![]() ;
;
(4)C的氢化物为H2O,E的氢化物为H2S,二者中水的沸点较高,原因是水分子之间存在氢键;
(5)碳与硝酸反应方程式为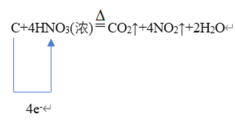 ,反应方程式中每转移4mol电子生成5mol气体,当转移0.2mol电子时时生成0.25mol气体,标况下为5.6L;
,反应方程式中每转移4mol电子生成5mol气体,当转移0.2mol电子时时生成0.25mol气体,标况下为5.6L;
(6)E单质为S,F单质为Cl2,,在水溶液反应会生成两种强酸,其化学反应方程式为S+3Cl2+4H2O=H2SO4+6HCl。

 导学全程练创优训练系列答案
导学全程练创优训练系列答案【题目】某温度下,在 2 L 恒容密闭容器中 3 种物质间进行反应,X、Y、Z 的物质的量随时间的变化曲线如图所示,反应在 t1 min 时达到平衡。
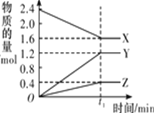
(1)请写出该反应的化学方程式:____________________________
(2)若上述反应中X、Y、Z 分别为NH3、H2、N2的一种,在此t1 min 时间内,用H2 表示该反应的平均速率υ(H2)为____________________________
(3)拆开 1mol 共价键所需吸收的能量如下表:
共价键 | H-H | N≡N | N-H |
吸收的能量/kJ | 436 | 946 | 391 |
1mol N2 完全反应生成NH3__________(填:吸收或放出多少)kJ 能量。但事实上,将 1molN2 和3molH2放在反应容器中,使它们充分反应,反应的热量变化总小于计算值,原因是________________________________
(4)下列叙述能判断该反应达到平衡状态的是___________(填字母代号)。
A.容器内各气体组分的质量分数不再发生改变
B.容器内气体的压强不再发生改变
C.容器内气体的密度不再发生改变
D.混合气体的平均相对分子质量不再发生改变