题目内容
Al-Mg在不同的电解质溶液中分别构成原电池A、B。如下图所示:
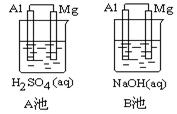
指出各池中的负极材料并写出其电极方程式。
①负极材料:
A池 ,B池 。
②电极反应式:
A池:正极 ,负极 。
B池:正极 ,负极 。
③从构成原电池的几个组成部分来看,判断原电池的负极,除了要考虑金属的活泼性外,还要考虑

指出各池中的负极材料并写出其电极方程式。
①负极材料:
A池 ,B池 。
②电极反应式:
A池:正极 ,负极 。
B池:正极 ,负极 。
③从构成原电池的几个组成部分来看,判断原电池的负极,除了要考虑金属的活泼性外,还要考虑
(1)①A池镁作负极材料,B池中铝作负极材料 ②A池:正极2H++2e-=H2↑,负极Mg-2e-=Mg2+;B池:正极6H2O+6e-=3H2↑+6OH-,负极2Al-6e-+8OH-=2AlO2-+4H2O;③池中能够发生的氧化还原反应
在A池中可与稀硫酸发生化学反应的有镁和铝Mg+H2SO4=MgSO4+H2↑;2Al+3H2SO4=Al2(SO4)3+3H2↑由于镁的金属活泼性大于铝,所以该电池中的化学反应为Mg+H2SO4=MgSO4+H2↑,镁失电子作电池负极,铝作正极。在B池中能发生的化学反应只有铝和碱的反应,即2Al+2NaOH+2H2O=2NaAlO2+3O2↑,所以该电池中铝失电子作电池负极,而镁只能作正极。

练习册系列答案
相关题目
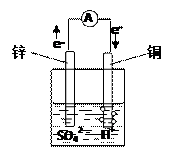

 H3O++S2-
H3O++S2- 2NH3(g) △H<0,其他条件不变时升高温度,反应速率V(H2)增大,氢气的平衡转化率变小
2NH3(g) △H<0,其他条件不变时升高温度,反应速率V(H2)增大,氢气的平衡转化率变小 O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1