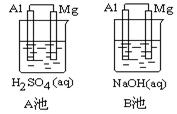
题目内容
将甲、乙两铂片插入200 g 10% CuSO4溶液中进行电解,当阳极析出0.16 g气体时,求:
(1)阴极析出多少克铜?剩余CuSO4溶液中溶质的质量分数是多少?
(2)需要多少电荷量?
(1)阴极析出多少克铜?剩余CuSO4溶液中溶质的质量分数是多少?
(2)需要多少电荷量?
(1)0.64 g;9.3 %
(2)1.93×103 C
(2)1.93×103 C
(1)这是一道化学与物理综合的试题,涉及的知识点有电化学、电学。电解的化学方程式为:
2CuSO4+2H2O 2Cu+O2↑+2H2SO4
2Cu+O2↑+2H2SO4
其中阳极放出O2,阴极生成Cu,设反应中生成Cu和消耗CuSO4的质量分别为x、y。
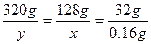
解得x="0.64" g,y="1.6" g。
w(CuSO4)=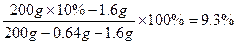 。
。
(2)由化学方程式中元素化合价变化可知:每生成1 mol O2时,转移4 mol e-,所以反应中通过的电荷量为:
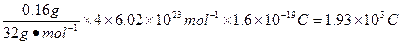 。
。
2CuSO4+2H2O
 2Cu+O2↑+2H2SO4
2Cu+O2↑+2H2SO4其中阳极放出O2,阴极生成Cu,设反应中生成Cu和消耗CuSO4的质量分别为x、y。
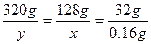
解得x="0.64" g,y="1.6" g。
w(CuSO4)=
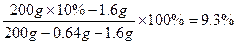 。
。 (2)由化学方程式中元素化合价变化可知:每生成1 mol O2时,转移4 mol e-,所以反应中通过的电荷量为:
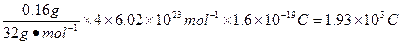 。
。
练习册系列答案
相关题目
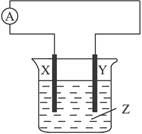
 Zn2++H2↑的反应原理设计一个原电池,当Zn为负极时,正极可以选用的金属材料是( )
Zn2++H2↑的反应原理设计一个原电池,当Zn为负极时,正极可以选用的金属材料是( )