题目内容
6.(1)现有如下两个反应:(A)NaOH+HCl=NaCl+H2O
(B)2FeCl3+Cu=2FeCl2+CuCl2
①根据两反应本质,判断能设计成原电池的反应是B(填序号).
(2)选择适宜的材料和试剂将(1)中你的选择设计为一个原电池.
①在图1的方框中画出装置图并说明电解质溶液.②写出电极反应式.
| 电极 | 电极材料 | 电极反应式 |
| 负极 | ||
| 正极 |
①该燃料电池的负极是a(写a或b).
②O2 (写化学式)发生还原反应.
③燃料电池中是将化学能转化为电能,总反应式是2H2+O2=2H2O.
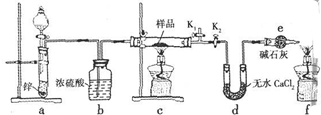
(4)锌锰干电池是最早使用的化学电池,其基本构造如图3所示.锌锰干电池的负极是锌,电路中每通过0.4mole-,负极质量减少13g;工作时NH4+离子在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是2NH4++2e-=2NH3↑+H2↑.
分析 (1)①原电池反应必须是自发进行的放热的氧化还原反应;
(2)根据反应议程式:2FeCl3+Cu=2FeCl2+CuCl2原电池电池反应中,失电子化合价升高的金属作负极,所以铜作负极,得电子化合价降低的电解质为该原电池中电解质,氯化铁溶液作为电解质溶液;设计原电池为: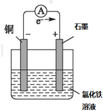 ;负极上失电子发生氧化反应,电极反应式为:Cu-2e-=Cu2+;碳作为正极铁离子在表面,得电子发生还原反应,电极反应式为:2Fe3++2e-=2Fe2+;
;负极上失电子发生氧化反应,电极反应式为:Cu-2e-=Cu2+;碳作为正极铁离子在表面,得电子发生还原反应,电极反应式为:2Fe3++2e-=2Fe2+;
(3)①负极氢气发生氧化反应;②正极发生还原反应,正极通的是氧气;③燃料电池中是将化学能转化为电能,总反应式是2H2+O2=2H2O;
(4)锌锰干电池的负极上Zn失去电子,负极消耗1mol时转移2mol电子,NH4+离子在正极放电产生2种气体,其中一种气体分子是含10e-的微粒为氨气,另一种为氢气.
解答 解:(1)①原电池反应必须是自发进行的放热的氧化还原反应,(A)反应中没有电子转移,不属于氧化还原反应,属于复分解反应,所以不能设计成原电池,(B)反应中Fe元素化合价由+3价变为+2价、Cu元素化合价由0价变为+2价,所以该反应有电子转移,属于氧化还原反应,且能自发进行、放热,所以能设计成原电池,故答案为:B;
(2)根据反应方程式:2FeCl3+Cu=2FeCl2+CuCl2,构成的原电池电池反应中,失电子化合价升高的金属作负极,所以铜作负极,得电子化合价降低的电解质为该原电池中电解质,氯化铁溶液作为电解质溶液;设计原电池为: ;负极上失电子发生氧化反应,电极反应式为:Cu-2e-=Cu2+;碳作为正极铁离子在表面,得电子发生还原反应,电极反应式为:2Fe3++2e-=2Fe2+;②正极上铁离子得电子发生还原反应,电极反应式为2Fe3++2e-=2Fe2+,负极上Cu失电子发生氧化反应,电极反应式为Cu-2e-=Cu2+,故答案为:
;负极上失电子发生氧化反应,电极反应式为:Cu-2e-=Cu2+;碳作为正极铁离子在表面,得电子发生还原反应,电极反应式为:2Fe3++2e-=2Fe2+;②正极上铁离子得电子发生还原反应,电极反应式为2Fe3++2e-=2Fe2+,负极上Cu失电子发生氧化反应,电极反应式为Cu-2e-=Cu2+,故答案为: ;
;
| 电极 | 电极材料 | 电极反应式 |
| 负极 | Cu | Cu-2e-=Cu2+ |
| 正极 | C | 2Fe3++2e-=2Fe2+ |
故答案为:a,O2,化学,电,2H2+O2=2H2O;
(4)锌锰干电池的负极上Zn失去电子,负极反应为Zn-2e-═Zn2+,负极消耗1mol时转移2mol电子,每通过0.4mole-,负极质量减少0.2mol×65g/mol=13.0g,由NH4+离子在正极放电产生2种气体,其中一种气体分子是含10e-的微粒为氨气,另一种为氢气,正极反应为2NH4++2e-═2NH3↑+H2↑,
故答案为:锌;13.0;2NH4++2e-═2NH3↑+H2↑.
点评 本题考查较为综合,涉及氧化还原反应及实验设计原电池、原电池的工作原理和电极反应式的书写以及相关计算,明确原电池的工作原理和电极反应式的书写的方法,题目难度中等.

 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案| A. | H2 和D2 互为同位素 | |
| B. | 40Ca和40K中质子数和中子数都不相等 | |
| C. | 只含一种元素的物质一定是纯净物 | |
| D. | 18O中中子数和质子数相等 |
| ① | ② | ③ | ④ | |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| pH | 11 | 11 | 3 | 3 |
| A. | V1L④与V2L②溶液混合后,若混合后溶液pH=4,则V1:V2=9:11 | |
| B. | 由水电离出的c(H+):①=②=③=④ | |
| C. | 分别加水稀释10倍、四种溶液的pH:①>②>③>④ | |
| D. | 在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变 |
| A. | 铪-185的原子核内有72个电子 | B. | 其中子数比电子数多41 | ||
| C. | 是铪-180的一种新的同素异形体 | D. | 铪-185的原子核内有185个质子 |
| A. | 化学反应速率可用单位时间内反应物或生成物的物质的量的变化表示 | |
| B. | 硫代硫酸钠与酸反应,一定产生淡黄色的浑浊现象 | |
| C. | 相同物质的量浓度的硫代硫酸钠与稀盐酸反应,其他条件不变,盐酸浓度越大,产生淡黄色浑浊越快 | |
| D. | 相同物质的量浓度的硫代硫酸钠与稀硫酸反应,温度越高,产生淡黄色浑浊越快 |
| A. | 由X,Y,Z组成的盐的水溶液中阳离子总浓度大于阴离子总浓度 | |
| B. | YX3的水溶液呈弱碱性,能使湿润的蓝色石蕊试纸变红 | |
| C. | X与Z形成的化合物的水溶液可用于雕刻玻璃 | |
| D. | W的氯化物熔点低,易升华,但其水溶液能导电,由此推断它属于弱电解质 |
 的名称为3,3,6-三甲基辛烷;
的名称为3,3,6-三甲基辛烷; 的名称为3,6-二甲基-1-庚炔;
的名称为3,6-二甲基-1-庚炔; ;
; ,分子式为C15H22O2;
,分子式为C15H22O2;  中含有的官能团的名称为羟基,酯基.
中含有的官能团的名称为羟基,酯基.