题目内容
14.现有常温下的四种溶液(如表),下列有关叙述中正确的是( )| ① | ② | ③ | ④ | |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| pH | 11 | 11 | 3 | 3 |
| A. | V1L④与V2L②溶液混合后,若混合后溶液pH=4,则V1:V2=9:11 | |
| B. | 由水电离出的c(H+):①=②=③=④ | |
| C. | 分别加水稀释10倍、四种溶液的pH:①>②>③>④ | |
| D. | 在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变 |
分析 一水合氨和醋酸是弱电解质,NaOH和盐酸是强电解质,氢氧根离子浓度相同的氨水和NaOH溶液中,一水合氨浓度比NaOH大,氢离子浓度相同的醋酸和盐酸中,醋酸浓度比盐酸大,加水稀释,促进弱电解质电离,弱电解质存在电离平衡,酸碱溶液中氢离子浓度与氢氧根离子浓度相同时,对水的电离的抑制作用相同,据此分析.
解答 解:A、②中氢氧根离子浓度为10-3mol/L,④中氢离子浓度为10-3mol/L,混合反应后溶液pH=4,说明氢离子过量,混合溶液中的氢离子浓度为10-4mol/L,10-4mol/L=$\frac{n({H}^{+})-n(O{H}^{-})}{{V}_{1}+{V}_{2}}$=$\frac{{V}_{1}L×1{0}^{-3}mol/L-{V}_{2}×1{0}^{-3}mol/L}{{V}_{1}+{V}_{2}}$,整理得V1:V2=11:9,故A错误;
B、①②中氢氧根离子浓度为10-3mol/L,③④中氢离子浓度为10-3mol/L,据Kw相同可知,有水电离出来的氢离子浓度相同,都是10-11mol/L,故B正确;
C、①氨水pH=11,平衡状态下氢氧根离子浓度为10-3mol/L;②氢氧化钠pH=11,氢氧根离子浓度为10-3mol/L;③醋酸pH=3,平衡状态下氢离子浓度为10-3mol/L;④硫酸pH=3,溶液中氢离子浓度为10-3mol/L;分别加水稀释10倍、四种溶液的pH大小为,碱比酸的pH大,弱碱弱酸存在电离平衡,加水稀释比强酸强碱的pH变化小,所以得到①>②>④>③,故C错误;
D、在①、②中分别加入适量的氯化铵晶体后,①中溶解形成的铵根对弱电解质的电离平衡起到了抑制作用,氢氧根离子浓度减小,pH减小;②中溶解的铵根离子与氢氧化钠溶液中的氢氧根离子会结合成弱电解质一水合氨,减小氢氧根离子的浓度,pH减小,故D错误;
故选B.
点评 本题考查了影响弱电解质的电离平衡的因素,酸碱混合时的定性分析和定量计算,溶液稀释时的pH变化判断,综合性较强.酸碱对水电离的抑制作用,注意酸碱溶液中氢离子浓度与氢氧根离子浓度相同时,对水的电离的抑制作用相同,题目难度不大.

| A. | NH4+、Ag+、CO32-、Cl- | B. | Fe3+、H+、I-、HCO3- | ||
| C. | K+、Na+、NO3-、Cl- | D. | H+、Fe2+、SO42-、NO3- |
| A. | 0.1mol/LNa2SO4溶液中含有的Na+数是0.2×6.02×1023 | |
| B. | 1molMg变成Mg2+时失去的电子数是6.02×1023 | |
| C. | 常温常压下,16gO2中含有的原子数是6.02×1023 | |
| D. | NO的摩尔质量与6.02×1023个NO分子的质量相等 |
(A)NaOH+HCl=NaCl+H2O
(B)2FeCl3+Cu=2FeCl2+CuCl2
①根据两反应本质,判断能设计成原电池的反应是B(填序号).
(2)选择适宜的材料和试剂将(1)中你的选择设计为一个原电池.
①在图1的方框中画出装置图并说明电解质溶液.②写出电极反应式.
| 电极 | 电极材料 | 电极反应式 |
| 负极 | ||
| 正极 |
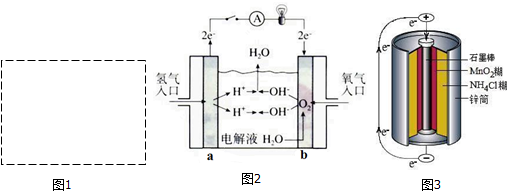
①该燃料电池的负极是a(写a或b).
②O2 (写化学式)发生还原反应.
③燃料电池中是将化学能转化为电能,总反应式是2H2+O2=2H2O.
(4)锌锰干电池是最早使用的化学电池,其基本构造如图3所示.锌锰干电池的负极是锌,电路中每通过0.4mole-,负极质量减少13g;工作时NH4+离子在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是2NH4++2e-=2NH3↑+H2↑.
| R | ||
| X | Y | Z |
| A. | Y的氢化物比Z的氢化物稳定 | |
| B. | 原子半径大小顺序是X>Y>R | |
| C. | Y、R形成的化台物YR3能使酸性KMnO4溶液褪色 | |
| D. | 四种元素中最高价氧化物的水化物的酸性最强的是Y |

 4-甲基-3-乙基-2-己烯
4-甲基-3-乙基-2-己烯 2,2,3-三甲基戊烷.
2,2,3-三甲基戊烷. 氨是化肥工业和基础化工的重要原料.请回答下列问题:
氨是化肥工业和基础化工的重要原料.请回答下列问题: