题目内容
17.卤代烃A的分子式为C4H9Br,其官能团的名称为溴原子,其同分异构体有4种.若A与KOH的乙醇溶液共热能生成两种产物,A的名称为2-溴丁烷、结构简式为CH3CH(Br)CH2CH3,写出其与KOH溶液共热发生水解反应的化学方程式CH3CH(Br)CH2CH3+KOH$\stackrel{H_{2}O}{→}$CH3CH(OH)CH2CH3+KBr.分析 卤代烃中官能团为卤素原子,丁基有几种,就有几种一卤代物,卤代烃与碱的乙醇溶液发生消去反应,与碱的水溶液发生取代反应,据此解答即可.
解答 解:卤代烃中官能团为卤素原子,C4H9Br的官能团为溴原子,丁基有4种,就有4种一卤代物,C4H9Br与KOH的乙醇溶液共热能生成两种产物,即消去反应的烯烃分别为1-丁烯和2-丁烯,故A为2-溴丁烷,结构简式为:CH3CH(Br)CH2CH3,卤代烃与氢氧化钾的水溶液发生取代反应,化学反应方程式为:CH3CH(Br)CH2CH3+KOH$\stackrel{H_{2}O}{→}$CH3CH(OH)CH2CH3+KBr,
故答案为:溴原子;4;2-溴丁烷;CH3CH(Br)CH2CH3;CH3CH(Br)CH2CH3+KOH$\stackrel{H_{2}O}{→}$CH3CH(OH)CH2CH3+KBr.
点评 本题主要考查的是卤代烃的性质、官能团的判断,主要考查的是卤代烃的消去反应和取代反应,难度不大.

练习册系列答案
相关题目
7.下列措施中,能减慢化学反应速率的是( )
| A. | 将块状固体药品研细后再反应 | |
| B. | 将H2O2溶液存放在低温冷暗处 | |
| C. | 用FeCl3溶液作H2O2分解反应的催化剂 | |
| D. | 用2 mol/L H2SO4溶液代替1 mol/L H2SO4溶液与锌粒反应 |
8.下列叙述中正确的是( )
| A. | 金属晶体的熔点和沸点都很高 | |
| B. | CH4、CCl4都是含有极性键的非极性分子 | |
| C. | HF、HCl、HBr、HI的稳定性依次增强 | |
| D. | H2O是一种非常稳定的化合物,这是由于氢键所致 |
9.下列说法正确的是( )
| A. | 0.1mol/LNa2SO4溶液中含有的Na+数是0.2×6.02×1023 | |
| B. | 1molMg变成Mg2+时失去的电子数是6.02×1023 | |
| C. | 常温常压下,16gO2中含有的原子数是6.02×1023 | |
| D. | NO的摩尔质量与6.02×1023个NO分子的质量相等 |
6.(1)现有如下两个反应:
(A)NaOH+HCl=NaCl+H2O
(B)2FeCl3+Cu=2FeCl2+CuCl2
①根据两反应本质,判断能设计成原电池的反应是B(填序号).
(2)选择适宜的材料和试剂将(1)中你的选择设计为一个原电池.
①在图1的方框中画出装置图并说明电解质溶液.②写出电极反应式.
(3)氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置,是一种具有应用前景的绿色电源.图2为氢氧燃料电池原理示意图,按照此图的提示回答下列问题:

①该燃料电池的负极是a(写a或b).
②O2 (写化学式)发生还原反应.
③燃料电池中是将化学能转化为电能,总反应式是2H2+O2=2H2O.
(4)锌锰干电池是最早使用的化学电池,其基本构造如图3所示.锌锰干电池的负极是锌,电路中每通过0.4mole-,负极质量减少13g;工作时NH4+离子在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是2NH4++2e-=2NH3↑+H2↑.
(A)NaOH+HCl=NaCl+H2O
(B)2FeCl3+Cu=2FeCl2+CuCl2
①根据两反应本质,判断能设计成原电池的反应是B(填序号).
(2)选择适宜的材料和试剂将(1)中你的选择设计为一个原电池.
①在图1的方框中画出装置图并说明电解质溶液.②写出电极反应式.
| 电极 | 电极材料 | 电极反应式 |
| 负极 | ||
| 正极 |

①该燃料电池的负极是a(写a或b).
②O2 (写化学式)发生还原反应.
③燃料电池中是将化学能转化为电能,总反应式是2H2+O2=2H2O.
(4)锌锰干电池是最早使用的化学电池,其基本构造如图3所示.锌锰干电池的负极是锌,电路中每通过0.4mole-,负极质量减少13g;工作时NH4+离子在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是2NH4++2e-=2NH3↑+H2↑.

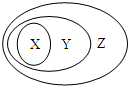 用图表示的一些物质或概念间的从属关系中错误的是( )
用图表示的一些物质或概念间的从属关系中错误的是( )
