题目内容
【题目】美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图所示:
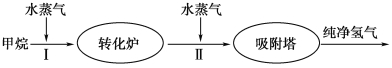
(1)此流程的第Ⅱ步反应为:CO(g)+H2O(g) ![]() H2(g)+CO2(g),该反应的化学平衡常数表达式为K=____________;反应的平衡常数随温度的变化如下表所示。
H2(g)+CO2(g),该反应的化学平衡常数表达式为K=____________;反应的平衡常数随温度的变化如下表所示。
温度/℃ | 400 | 500 | 830 | 1 000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
从上表可以推断:此反应是__________(填“吸”或“放”)热反应。
在830 ℃下,若开始时向恒容密闭容器中充入CO与H2O均为1 mol,则达到平衡后CO的转化率为________。
(2)此流程的第Ⅱ步反应CO(g)+H2O(g) ![]() H2(g)+CO2(g),在830 ℃时,以下表的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有________(填实验编号)。
H2(g)+CO2(g),在830 ℃时,以下表的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有________(填实验编号)。
实验编号 | n(CO) | n(H2O) | n(H2) | n(CO2) |
A | 1 | 5 | 2 | 3 |
B | 2 | 2 | 1 | 1 |
C | 0.5 | 2 | 1 | 1 |
(3)在一个不传热的固定容积的容器中,判断此流程的第Ⅱ步反应达到平衡的标志是________(填序号)。
①体系的压强不再发生变化 ②混合气体的密度不变 ③混合气体的平均相对分子质量不变 ④各组分的物质的量浓度不再改变 ⑤体系的温度不再发生变化 ⑥v(CO2正)=v(H2O逆)
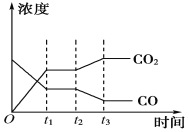
(4)下图表示此流程的第Ⅱ步反应在t1时刻达到平衡,在t2时刻分别因改变某个条件而发生变化的情况:图中t2时刻发生改变的条件可能是________________________(写出两种)。
【答案】c(H2).c(CO2)/[c(CO)c(H2)] 放 50% B ①④⑤⑥ 降低温度或增加水蒸气的量或减少氢气的量
【解析】
(1)K为生成物浓度幂之积与反应物浓度幂之积的比,由表格中的数据可知,温度越大,K越小,则正反应为放热反应,利用830℃下K计算CO的转化率;
(2)利用Q与K的关系可知,Q<K时反应向正反应反应移动;
(3)利用平衡的特征“定”、“等”及由此衍生的物理量来分析;
(4)t2时二氧化碳的浓度增大,而CO的浓度减小,该反应正向移动,以此分析。
(1)K为生成物浓度幂之积与反应物浓度幂之积的比,则K=c(H2).c(CO2)/[c(CO).c(H2)],由表格中的数据可知,温度越高,K越小,则正反应为放热反应,830℃时,
CO(g)+H2O(g)![]() H2(g)+CO2(g),
H2(g)+CO2(g),
开始(mol) 1 1 0 0
转化(mol) x x x x
平衡(mol) 1-x 1-x x x
K=x×x/(1-x)×(1-x)=1,解得x=0.5,则CO的转化率为0.5/1×100%=50%,
故答案为:c(H2)c(CO2)/[c(CO)c(H2)];放;50%。
(2)A.Q=2×3/1×5=1.2>K=1,则向逆反应方向移动,故A不选;
B.Q=1×1/2×2=0.25<K=1,则反应向正反应反应移动,故B选;
C.Q=1×1/0.5×2==K,平衡不移动,故C不选;
故答案为:B。
(3)①该反应在不传热的容器中进行,反应过程中容器内的温度会发生变化,温度变化必然引起压强的变化,则体系的压强不再发生变化时,说明反应达到平衡,故①选;
②固定容积,质量、体积始终不变,则混合气体的密度不变,不能判断平衡,故②不选;
③混合气体的总质量、总物质的量始终不变,则混合气体的平均相对分子质量不变,不能判断平衡,故③不选;
④各组分的物质的量浓度不再改变,为平衡的特征,能判断平衡,故④选;
⑤体系的温度不再发生变化,说明正反应速率等于逆反应速率,反应达到平衡,故⑤选;
⑥v正(CO2)=v逆(H2O),则水的正、逆反应速率相等,达到平衡,故⑥选。
故答案为:①④⑤⑥。
(4)t2时二氧化碳的浓度增大,而CO的浓度减小,该反应正向移动,则改变的条件为降低温度或增加水蒸汽的量或减少氢气的量,
故答案为:降低温度或增加水蒸汽的量或减少氢气的量。

【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液(混合液)的pH如下表,请回答:
实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | C | 0.2 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=9 |
(1)不考虑其它组的实验结果,仅从甲组情况分析,如何用a (混合液的pH)来说明HA是强酸还是弱酸__________。
(2) 不考虑其它组的实验结果,仅从乙组情况分析,C是否一定等于0.2__________(填“是”或“否”)。混合液中离子浓度c(A-)与 c(Na+)的大小关系是__________。
(3)丙组实验结果分析,HA是__________酸(填“强”或“弱”)。该组混合液中离子浓度由大到小的顺序是__________。
(4)丁组实验混合液中由水电离出的c(OH-)=__________molL﹣1,写出该混合液中下列算式的精确结果(不需做近似计算)。
c(Na+)-c(A-)=__________molL-1, c(OH-)-c(HA)=__________molL-1。
【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NO2反应进行了探究。回答下列问题:
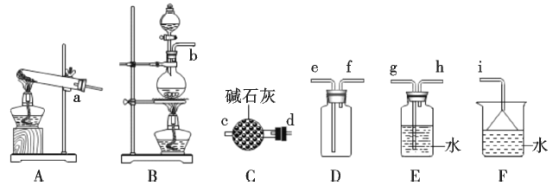
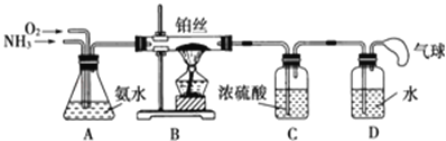
(1)氨气的制备
①氨气的发生装置中反应的化学方程式为__。装置C的仪器名称__。
②欲收集一瓶干燥的氨气,选择上图中的装置,其接口连接顺序为a→__(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。
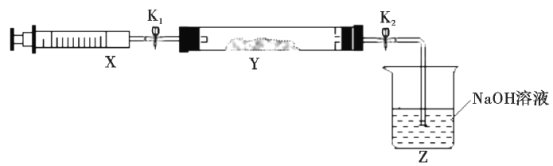
操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢充入Y管中 | ①Y管中__ | ②反应的化学方程式___ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝聚 |
打开K2 | ③__ | ④___ |