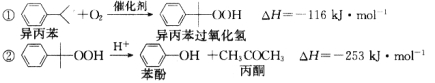
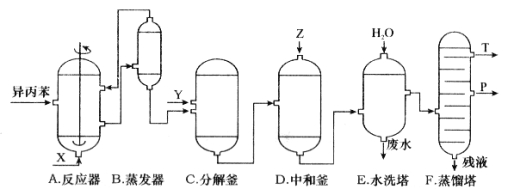
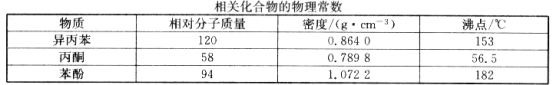
题目内容
【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液(混合液)的pH如下表,请回答:
实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | C | 0.2 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=9 |
(1)不考虑其它组的实验结果,仅从甲组情况分析,如何用a (混合液的pH)来说明HA是强酸还是弱酸__________。
(2) 不考虑其它组的实验结果,仅从乙组情况分析,C是否一定等于0.2__________(填“是”或“否”)。混合液中离子浓度c(A-)与 c(Na+)的大小关系是__________。
(3)丙组实验结果分析,HA是__________酸(填“强”或“弱”)。该组混合液中离子浓度由大到小的顺序是__________。
(4)丁组实验混合液中由水电离出的c(OH-)=__________molL﹣1,写出该混合液中下列算式的精确结果(不需做近似计算)。
c(Na+)-c(A-)=__________molL-1, c(OH-)-c(HA)=__________molL-1。
【答案】a=7为强酸,a>7为弱酸; 否 c(A-)=c(Na+) 弱 c(Na+)>c(A-)>c(OH-)>c(H+) 10﹣5 10﹣5﹣10﹣9 10﹣9
【解析】
(1)酸碱的物质的量相等,如为强酸,反应后溶液呈中性,如为弱酸,反应后溶液呈酸性;
(2)从溶液电中性的角度分析;
(3)等物质的量的酸碱反应后溶液呈碱性,由于NaOH为强碱,则该酸为弱酸;
(4)等物质的量的酸碱反应后溶液呈碱性,溶液中氢氧根离子全部来自于弱酸根离子水解得到的,水电离出的氢离子等于水电离出的氢氧根离子,根据电荷守恒计算。
(1)一元酸HA和NaOH溶液等体积混合,两种溶液的物质的量浓度都为0.2mol/L,则酸碱的物质的量相等,如a=7,说明反应后溶液呈中性,则HA是强酸,如a>7,反应后呈碱性,则HA是弱酸,
故答案为:a=7,HA是强酸;a>7,HA是弱酸。
(2)反应后溶液呈中性,如HA为强酸,则c=0.2,如HA为弱酸,则c>0.2,仅从乙组情况分析,c不一定等于0.2,由于反应后溶液呈中性,则有c(OH-)=c(H+),根据溶液呈中性,则有c(Na+)+c(H+)=c(A-)+c(OH-),所以c(A-)=c(Na+),
故答案为:否,=。
(3)等物质的量的酸碱反应后溶液呈碱性,由于NaOH为强碱,则该酸为弱酸,在溶液中存在A-+H2O![]() HA+OH-,则c(Na+)>c(A-),溶液呈碱性,则c(OH-)>c(H+),一般来说,盐类的水解程度较低,则有c(A-)>c(OH-),所以有:c(Na+)>c(A-)>c(OH-)>c(H+),
HA+OH-,则c(Na+)>c(A-),溶液呈碱性,则c(OH-)>c(H+),一般来说,盐类的水解程度较低,则有c(A-)>c(OH-),所以有:c(Na+)>c(A-)>c(OH-)>c(H+),
故答案为:弱,c(Na+)>c(A-)>c(OH-)>c(H+)。
(4)丁组实验所得混合溶液为浓度为0.5mol/L的NaA溶液,其pH=9,则氢离子浓度为10-9mol/L,等物质的量的酸碱反应后溶液呈碱性,溶液中氢氧根离子全部来自于弱酸根离子水解得到的,c(OH-)=Kw/c(H+)=10-14/10-9mol/L=10-5mol/L,即水电离出的氢氧根离子浓度为10-5mol/L,根据电荷守恒得:c(Na+)+c(H+)=c(A-)+c(OH-),所以c(Na+)-c(A-)=c(OH-)-c(H+)=(10-5-10-9)mol/L,由物料守恒可知,c(A-)+c(HA)=c(Na+),c(Na+)-c(A-)=c(OH-)-c(H+)=c(HA),则c(OH-)-c(HA)=c(H+)=10-9mol/L,
故答案为:10-5,10-5-10-9,10-9。

【题目】美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图所示:
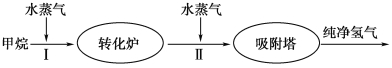
(1)此流程的第Ⅱ步反应为:CO(g)+H2O(g) ![]() H2(g)+CO2(g),该反应的化学平衡常数表达式为K=____________;反应的平衡常数随温度的变化如下表所示。
H2(g)+CO2(g),该反应的化学平衡常数表达式为K=____________;反应的平衡常数随温度的变化如下表所示。
温度/℃ | 400 | 500 | 830 | 1 000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
从上表可以推断:此反应是__________(填“吸”或“放”)热反应。
在830 ℃下,若开始时向恒容密闭容器中充入CO与H2O均为1 mol,则达到平衡后CO的转化率为________。
(2)此流程的第Ⅱ步反应CO(g)+H2O(g) ![]() H2(g)+CO2(g),在830 ℃时,以下表的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有________(填实验编号)。
H2(g)+CO2(g),在830 ℃时,以下表的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有________(填实验编号)。
实验编号 | n(CO) | n(H2O) | n(H2) | n(CO2) |
A | 1 | 5 | 2 | 3 |
B | 2 | 2 | 1 | 1 |
C | 0.5 | 2 | 1 | 1 |
(3)在一个不传热的固定容积的容器中,判断此流程的第Ⅱ步反应达到平衡的标志是________(填序号)。
①体系的压强不再发生变化 ②混合气体的密度不变 ③混合气体的平均相对分子质量不变 ④各组分的物质的量浓度不再改变 ⑤体系的温度不再发生变化 ⑥v(CO2正)=v(H2O逆)
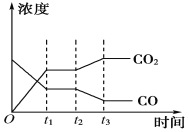
(4)下图表示此流程的第Ⅱ步反应在t1时刻达到平衡,在t2时刻分别因改变某个条件而发生变化的情况:图中t2时刻发生改变的条件可能是________________________(写出两种)。