题目内容
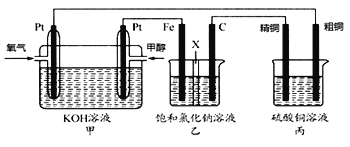
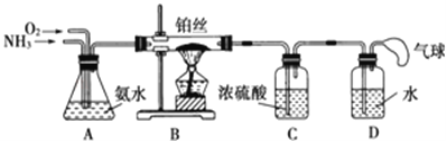
【题目】学生设计的用氨催化氧化法制取少量HNO3溶液的实验装置如图所示:
(1)实验室制备NH3,下列方法中适宜选用的是__(填序号)。
①固态氯化铵与熟石灰混合加热
②固态氯化铵加热分解
③碱石灰中滴加浓氨水
④氯化铵溶液与氢氧化钠溶液共热
(2)装置B中发生反应的化学方程式为__;
(3)装置C的作用是__;装置C中的现象___;为确保装置D中尽可能多地生成HNO3,所通入O2和NH3的体积比应大于___;
(4)装置D中发生的反应化学方程式为___。(请分步写出化学方程式)
【答案】①③ 4NH3+5O2![]() 4NO+6H2O 吸收未反应的NH3 气泡从浓硫酸中冒出,且装置C内的上部呈红棕色 2:1 3NO2+H2O═2HNO3+NO、2NO+O2=2NO2
4NO+6H2O 吸收未反应的NH3 气泡从浓硫酸中冒出,且装置C内的上部呈红棕色 2:1 3NO2+H2O═2HNO3+NO、2NO+O2=2NO2
【解析】
NH3与O2一起通入A装置,可以将两种气体混合,还能通过A中冒气泡的情况调节两种气体进入的速率;A中盛放氨水是为了防止NH3溶解;气体进入B装置后,在Pt丝的催化下发生反应:4NH3+5O2![]() 4NO+6H2O,混合气体经过浓硫酸吸收NH3后进入D装置,与H2O反应生成HNO3。
4NO+6H2O,混合气体经过浓硫酸吸收NH3后进入D装置,与H2O反应生成HNO3。
(1) ①固态氯化铵与熟石灰混合加热是实验室制氨气的主要方法,①选;
②固态氯化铵加热分解成氨气和氯化氢,氯化氢和氨气遇冷重新反应生成氯化铵,不能制得氨气,②不选;
③碱石灰中滴加浓氨水,碱石灰溶于水放热促进一水合氨分解,且增大氢氧根离子浓度促进氨气逸出,也是实验室制氨气的方法之一,③选;
④氯化铵溶液与氢氧化钠溶液共热,可以生成氨气,但氨气极易溶于水,所以此方法制得氨气量少,不适合实验室制备氨气,④不选;
故选:①③;
(2)氨催化氧化生成一氧化氮和水,方程式为: 4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(3)装置C中浓硫酸的作用是吸收未反应的NH3,装置B中产生的NO通过浓硫酸时,可看到浓硫酸中有气泡冒出,同时NO在装置C的上部与O2迅速反应生成红棕色的NO2;为确保装置D中尽可能多地生成HNO3,就是NH3通过转化后全部生成HNO3,由4NH3+5O2![]() 4NO+6H2O及4NO+3O2+2H2O=4HNO3可得: NH3+2O2=HNO3+H2O,由此可见通入O2和NH3的体积比应大于2: 1;
4NO+6H2O及4NO+3O2+2H2O=4HNO3可得: NH3+2O2=HNO3+H2O,由此可见通入O2和NH3的体积比应大于2: 1;
(4)在装置D中,NO2与H2O反应生成硝酸和一氧化氮,方程式为: 3NO2+H2O=2HNO3+NO,生成的NO又可以和O2反应,方程式为: 2NO+O2=2NO2。

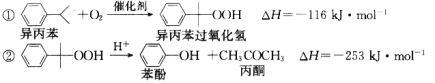
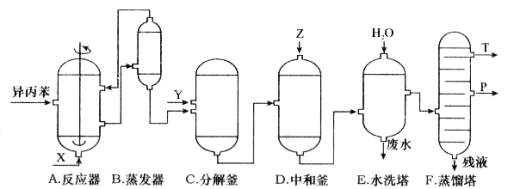
【题目】美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图所示:
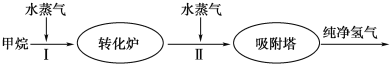
(1)此流程的第Ⅱ步反应为:CO(g)+H2O(g) ![]() H2(g)+CO2(g),该反应的化学平衡常数表达式为K=____________;反应的平衡常数随温度的变化如下表所示。
H2(g)+CO2(g),该反应的化学平衡常数表达式为K=____________;反应的平衡常数随温度的变化如下表所示。
温度/℃ | 400 | 500 | 830 | 1 000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
从上表可以推断:此反应是__________(填“吸”或“放”)热反应。
在830 ℃下,若开始时向恒容密闭容器中充入CO与H2O均为1 mol,则达到平衡后CO的转化率为________。
(2)此流程的第Ⅱ步反应CO(g)+H2O(g) ![]() H2(g)+CO2(g),在830 ℃时,以下表的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有________(填实验编号)。
H2(g)+CO2(g),在830 ℃时,以下表的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有________(填实验编号)。
实验编号 | n(CO) | n(H2O) | n(H2) | n(CO2) |
A | 1 | 5 | 2 | 3 |
B | 2 | 2 | 1 | 1 |
C | 0.5 | 2 | 1 | 1 |
(3)在一个不传热的固定容积的容器中,判断此流程的第Ⅱ步反应达到平衡的标志是________(填序号)。
①体系的压强不再发生变化 ②混合气体的密度不变 ③混合气体的平均相对分子质量不变 ④各组分的物质的量浓度不再改变 ⑤体系的温度不再发生变化 ⑥v(CO2正)=v(H2O逆)
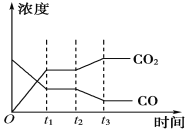
(4)下图表示此流程的第Ⅱ步反应在t1时刻达到平衡,在t2时刻分别因改变某个条件而发生变化的情况:图中t2时刻发生改变的条件可能是________________________(写出两种)。