题目内容
【题目】![]() 燃料电池具有理论电压高、能量密度大等优点。以该燃料电池为电源电解精炼铜的装置如图所示。下列说法不正确的是
燃料电池具有理论电压高、能量密度大等优点。以该燃料电池为电源电解精炼铜的装置如图所示。下列说法不正确的是
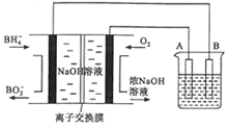
A. 每消耗2.24![]() (标准状况)时,A电极的质量减轻12.8g
(标准状况)时,A电极的质量减轻12.8g
B. 离子交换膜应为阳离子交换膜,![]() 由左极室向右极室迁移
由左极室向右极室迁移
C. 该燃料电池的负极反应式为![]()
D. 粗铜中的Ag、Au沉在阳极区,电解质溶液的浓度基本保持不变
【答案】A
【解析】
碱性燃料电池中,通入NaBH4的一极为原电池的负极,发生氧化反应,电极反应式为![]() ,通入O2的一极为原电池的正极,发生还原反应,电极反应式为O2+4e-+2H2O=4OH-,A为电解池的阳极,发生氧化反应,B为电解池的阴极,发生还原反应,电极反应式为Cu2++2e-=Cu,由此分析解答.
,通入O2的一极为原电池的正极,发生还原反应,电极反应式为O2+4e-+2H2O=4OH-,A为电解池的阳极,发生氧化反应,B为电解池的阴极,发生还原反应,电极反应式为Cu2++2e-=Cu,由此分析解答.
A. A极上有比铜活泼的Zn、Fe等金属优先放电,所以每消耗2.24L(标准状况)O2时,A电极的质量不一定减轻12.8g,故A错误.
B. 离子交换膜应为阳离子交换膜,左极室消耗氢氧根离子,钠离子由左极室向右极室迁移,故B正确;
C. 该燃料电池中,通入NaBH4的一极为原电池的负极,发生氧化反应,电极反应式为![]() ,故C正确;
,故C正确;
D. Ag、Au的活泼性比铜差,所以Ag、Au沉在阳极区,电解质溶液的浓度基本保持不变,故D正确;
综上所述,本题应选A。

 阶梯计算系列答案
阶梯计算系列答案【题目】现使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL)
Ⅰ.实验步骤
(1)配制100mL待测白醋溶液:用______![]() 填仪器名称
填仪器名称![]() 量取10.00mL市售白醋,在烧杯中用水稀释后转移到______
量取10.00mL市售白醋,在烧杯中用水稀释后转移到______![]() 填仪器容量、名称
填仪器容量、名称![]() 中定容,摇匀即得待测白醋溶液.
中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴_____作指示剂.
(3)读取盛装0.1000mol/LNaOH溶液的碱式滴定管的初始读数:如果液面位置如图所示,则此时的读数为______mL.
![]()
(4)滴定:当________________________________________时,停止滴定,并记录NaOH溶液的终读数,重复滴定3次。
Ⅱ.实验记录
滴定次数实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) |
|
|
|
|
V(NaOH)(消耗) |
|
|
|
|
Ⅲ.数据处理与讨论
(5)甲同学在处理数据时计算得:平均消耗的NaOH溶液的体积:V=![]() =15.24mL指出他的计算的不合理之处:_________________________________________________。
=15.24mL指出他的计算的不合理之处:_________________________________________________。
选取正确数据,可得![]() 市售白醋
市售白醋![]() ____mol/L;市售白醋总酸量
____mol/L;市售白醋总酸量![]() ____g/100mL。
____g/100mL。
(6)乙同学仔细研究了该品牌白醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法验证醋酸与苯甲酸钠不会发生离子互换反应,需查找在一定温度下的醋酸与苯甲酸的________(填标号).
A.pHB.电离度C.电离常数D.溶解度
(7)在本实验的滴定过程中,下列操作会使实验结果偏大的是______(填标号).
A.碱式滴定管在用蒸馏水洗净后,未用标准NaOH溶液润洗
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加少量水
D.锥形瓶在滴定时剧烈摇动,有少量液体溅出.
【题目】胆矾![]() 是一种重要的含铜化合物,某课外研究小组用粗铜(含少量
是一种重要的含铜化合物,某课外研究小组用粗铜(含少量![]() )通过不同的化学反应制取胆矾的过程如图:
)通过不同的化学反应制取胆矾的过程如图:

物质 | 完全沉淀时的pH |
Fe(OH)3 | 3.2 |
Fe(OH)2 | 9.6 |
Cu(OH)2 | 6.4 |
当溶液中被沉淀离子的物质的量浓度小于![]() 时,认为该离子沉淀完全。
时,认为该离子沉淀完全。
试回答下列问题:
(1)下列物质中,最适合作为试剂X的是________(填序号)。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(2)由粗铜通过两种途径制取胆矾,与途径Ⅱ相比,途径Ⅰ有明显的两个优点,分别是______________、____________________。
(3)试剂Y可以是______________________(任填一种物质的化学式)。
(4)若溶液C中![]() 、
、![]() 的浓度分别为
的浓度分别为![]() 、
、![]() ,则向溶液C中加入少量试剂Y的过程中应控制溶液C的pH范围约为________。
,则向溶液C中加入少量试剂Y的过程中应控制溶液C的pH范围约为________。
(5)氢化亚铜![]() 是一种红色固体,40~50℃时,滤液E和
是一种红色固体,40~50℃时,滤液E和![]() 溶液混合反应可得氢化亚铜沉淀,同时得到硫酸和磷酸,该反应的离子方程式为___________________________________,该反应每转移1.5
溶液混合反应可得氢化亚铜沉淀,同时得到硫酸和磷酸,该反应的离子方程式为___________________________________,该反应每转移1.5![]() 个电子,生成CuH的物质的量为________mol。
个电子,生成CuH的物质的量为________mol。
(/span>6)纳米氧化亚铜![]() 是一种用途广泛的光电材料,电化学法可用铜棒和石墨作电极,电解滤液E获得纳米氧化亚铜,电解过程中无气体产生,则铜棒作________极,生成
是一种用途广泛的光电材料,电化学法可用铜棒和石墨作电极,电解滤液E获得纳米氧化亚铜,电解过程中无气体产生,则铜棒作________极,生成![]() 的电极反应式为______________________,电解过程中滤液E的浓度____________(填“增大”“不变”或“减小”)。
的电极反应式为______________________,电解过程中滤液E的浓度____________(填“增大”“不变”或“减小”)。
(7)得到![]() 晶体,乙醇代替蒸馏水洗涤晶体的目的是______________。
晶体,乙醇代替蒸馏水洗涤晶体的目的是______________。
【题目】美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图所示:
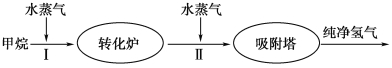
(1)此流程的第Ⅱ步反应为:CO(g)+H2O(g) ![]() H2(g)+CO2(g),该反应的化学平衡常数表达式为K=____________;反应的平衡常数随温度的变化如下表所示。
H2(g)+CO2(g),该反应的化学平衡常数表达式为K=____________;反应的平衡常数随温度的变化如下表所示。
温度/℃ | 400 | 500 | 830 | 1 000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
从上表可以推断:此反应是__________(填“吸”或“放”)热反应。
在830 ℃下,若开始时向恒容密闭容器中充入CO与H2O均为1 mol,则达到平衡后CO的转化率为________。
(2)此流程的第Ⅱ步反应CO(g)+H2O(g) ![]() H2(g)+CO2(g),在830 ℃时,以下表的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有________(填实验编号)。
H2(g)+CO2(g),在830 ℃时,以下表的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有________(填实验编号)。
实验编号 | n(CO) | n(H2O) | n(H2) | n(CO2) |
A | 1 | 5 | 2 | 3 |
B | 2 | 2 | 1 | 1 |
C | 0.5 | 2 | 1 | 1 |
(3)在一个不传热的固定容积的容器中,判断此流程的第Ⅱ步反应达到平衡的标志是________(填序号)。
①体系的压强不再发生变化 ②混合气体的密度不变 ③混合气体的平均相对分子质量不变 ④各组分的物质的量浓度不再改变 ⑤体系的温度不再发生变化 ⑥v(CO2正)=v(H2O逆)
(4)下图表示此流程的第Ⅱ步反应在t1时刻达到平衡,在t2时刻分别因改变某个条件而发生变化的情况:图中t2时刻发生改变的条件可能是________________________(写出两种)。