题目内容
【题目】某实验小组同学进行如下实验,以检验化学反应中的能量变化。
(1)实验中发现,反应后①中的温度升高;②中的温度降低.由此判断铝条与盐酸的反应是______热反应, Ba(OH)28H2O与NH4Cl反应时,需要将固体研细其目的是________________.反应过程______ (填“①”或“②”)的能量变化可用图表示。

(2)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的是_________(填序号)。

(3)将CH4设计成燃料电池,其利用率更高,装置如图所示(a、b为多孔碳棒)其中____(填A或B)处电极入口通甲烷,其电极反应式为_____________________ 。当消耗标况下甲烷33.6L时,假设能量转化率为90%,则导线中转移电子的物质的量为_________mol。
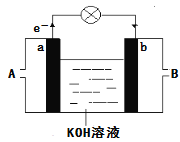
(4)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:

①当电极c为Al、电极d为Cu、电解质溶液为稀硫酸时,写出该原电池正极的电极反应式为_______________。
②当电极c为Al、电极d为Mg、电解质溶液为氢氧化钠溶液时,该原电池的正极为_______;该原电池的负极反应式为_____________________________。
【答案】放 扩大接触面积,提高反应速率 ① ② A CH4﹣8e—+10OH﹣=CO32—+7H2O 10.8 2H++2e—═H2↑ Mg Al+4OH—﹣3e—=AlO2—+2H2O
【解析】
根据反应物和生成物具有总能量的大小判断吸热反应还是放热反应;根据原电池原理分析电池的正负极及书写电极反应式;根据电极反应式计算电子的转移。
(1)温度升高,说明反应为放热;将固体研细其目的是扩大接触面积,提高反应速率;图示中反应物的总能量高于生成物的总能量,反应为放热反应,反应①为放热反应,故答案为: 放;扩大接触面积,提高反应速率;①;
(2)为了验证Fe3+与Cu2+氧化性强弱,可以利用原电池原理,装置②中发生的总反应为Cu与Fe3+反应生成Fe2+,根据氧化还原反应原理知强化剂的氧化性强于氧化产物的氧化性,所以验证了Fe3+与Cu2+氧化性强弱,故答案为②;
(3)由图所示,电子从A极流出,则A电极入口通甲烷,其电极反应式为:CH4﹣8e—+10OH﹣=CO32—+7H2O;根据电极反应知:n(8e-)=8n(CH4)=![]() ,若能量转化率为90%,则导线中转移电子的物质的量为12mol×90%=10.8mol;
,若能量转化率为90%,则导线中转移电子的物质的量为12mol×90%=10.8mol;
(4)①正极氢离子得电子,电极反应式为 2H++2e—═H2↑;
②因为Al和氢氧化钠溶液反应、而Mg不反应,所以负极是铝、Mg作正极;该原电池的负极反应式为: Al+4OH—﹣3e—=AlO2—+2H2O。

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案